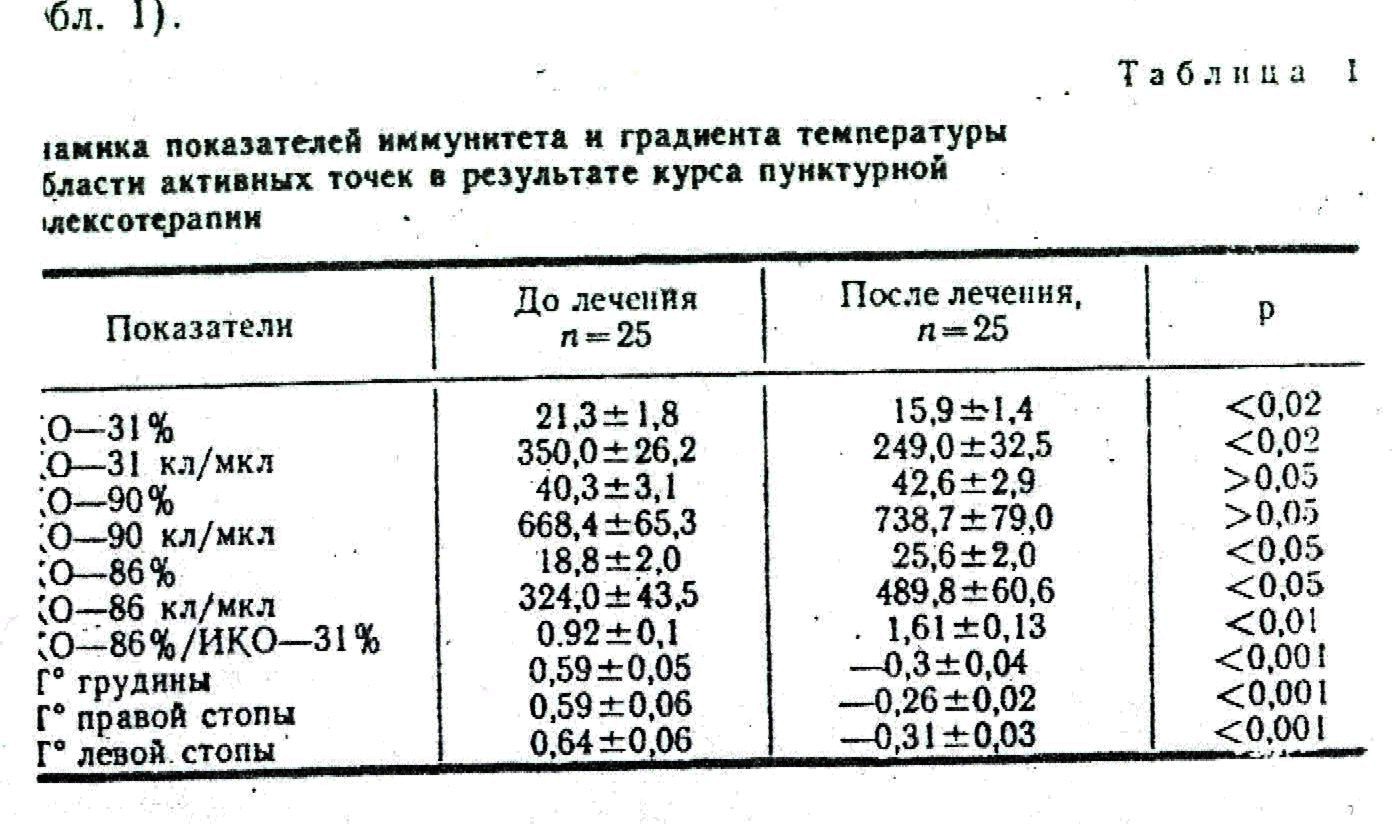
ЭКОЛОГИЧЕСКИЙ СПИД. ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ ЕГО ТЕПЛОВИЗИОННОИ РЕФЛЕКСОДИАГНОСТИКИ И ПУНКТУРНОЙ РЕФЛЕКСОТЕРАПИИМ. В . Вогралик, Г. Г РасторгуевВесь мир потрясен “чумой XX века”—ВИЧ- инфекцией (фигурирующей обычно под неточным названием СПИД), которая, но мнению многих специалистов, обрекает на вымирание значительную часть человечества. Однако, весьма вероятно, большую опасность представляет экологический СПИД (синдром приобретенного иммунодефицита), обусловленный пока неотвратимо нарастающими нарушениями среды обитания человека. С ним связано возникновение наиболее грозных и социально значимых болезней современного человека -“болезней цивилизации”: преждевременное старение, атеросклероз с таким осложнением, как инфаркт сердца или мозга, рак, хронические инфекции, болезни обмена веществ, и частности подагра и сахарный диабет, аллергические и аутоаллергические заболевания (В. Г. Вогралик). При этом играет роль не только прямое патогенное стрессорное, токсическое и друтие действия средовых факторов на организм. Как указывает Р. В. Петров, следует говорить и о важности сохранения естественных биоценозов, что является оптимальным способом профилактики иммунологического (антигенного) упрощения окружающей среды. Экологическое здоровье человека через нормальное функционирование иммунной системы неразрывно связывается с сохранением многообразия всех других форм жизни. Предпринятая под руководствам Института иммунологии МЗ СССР работа по исследованию иммунологического статуса населения нашей страны (Е. В, Пинегин, И. В, Орадовская н др.) выявила тенденцию к общему существенному снижению показателей иммунитета в большинстве регионов страны. С. И. Пылаева, А. Гординская, И. Р. Вазина и С. В. Кораблев установили, что в Нижнем Новгороде как у практически здоровых людей, так и животных в течение последних 20 лет неуклонно снижалась, фагоцитарная способность лейкоцитов крови и альвеолярных макрофагов. Причем каждое последующее десятилетие характеризуется двукратным снижением показателей. Г. Н. Варварина нашла значительные иммунные сдвиги у школьников и студентов при нарушении здорового образа жизни, клинически проявлявшиеся учащением простудно -инфекционных заболеваний, метаболическими микроциркуляторными нарушениями, свойственными преждевременному старению. К сожалению, в настоящее время это распространяется не только на промышленные города, но и на сельские районы вследствие преступно чрезмерного применения пестицидов, гербицидов, минеральных удобрений. Конечно, особенно неблагоприятное положение сложилось в зоне экологических катастроф, регионов. пострадавших от чернобыльской аварии, в ряде районов Урала, Сибири, Аральского моря, бассейне Волги. Трагическая ситуация сложилась в городах химиков, таких, как Дзержинск, промышленные центры Кузбасса и др. (С. Л. Гольвидис и др.).Однако не меньшее значение в развитии экологического СПИДа играют огромные психические и физические стрессорныс нагрузки, которым подвергается современный человек (Е. А. Корнева с сотр., В. Матаева, А. И. Поляк). В соответствии с разработанной нами с Л. В. Ковальчуком клинической классификацией можно говорить о трех формах вторичных экологически обусловленных нммунодефицитных состояний ИДС), связанных с действием разных причин и имеющих неодинаковый патогенез. Во-первых, это дизрегулярные ИДС, обусловленные действием чрезмерных стрессорных нагрузок, что приводит к нарушению нейгормонально - метаболической и микроциркуляторной регуляции органов иммуногенеза. Типичный пример — развитие иммунной незащищенности у спортсменов в период ответственных соревнований. Аналогичные явления наблюдались у наших солдат в Афганистане, где вследствие чрезмерных психических, физических стрессов в условиях жаркого климата, при резкой потере массы тела развивался типичный экологический СПИД, вследствие которого, например, поголовно иммунизированные против брюшного тифа солдаты заражались и тяжело болели этой болезнью (В.. И. Кожокарь). Накопление повседневных стрессорно обусловленных нарушений иммунного статуса при нарушении ритма жизни, отсутствии полноценного отдыха и эмоционального расслабления человека ведет к ускоренной инволюции тимуса, является одной из главных причин преждевременного старения, npогрессивного сокращении продолжительности жизни, характерного для нашего общества. Во-вторых, это прямое системное поражение органов иммуногенеза, а также циркулирующих в крови, лимфе, депонированных в тканях иммунных клеток. Причины этого явления разнообразны: радиация, рентгеновское облучение, действие разнообразных продуктов химического производства, и том числе при их накоплении в продуктах питания, синтетических лекарств, микробных токсинов, 'ВЧ- и лазерного облучепия. радиоволн и пр. Причиной может быть нарушение качественной сбалансированности питания, приводящее, например, из-за .хронического белкового голодания в странах Африки к развитию у детей тяжелейшего состояния - квашиоркора. Накопление в крови атерогенных форм холестерина также вызывает ИДС вследствии блокады мстаболизма лимфоцитов кропи (В. М. Дильма.)). Патогенез экологического СПИДа на уровне клеточных рецепторов изучен А. А. Ярчлиным, А М. Василенко и может быть обусловлен нарушениями обмена циклических монофосфатов, а также активацией ферментов, разрывающих нити ДНК между нуклеосомами, что приводит к деградации хроматина и гибели клетки.В-третьих, в соответствии со взглядами Л. Г. Чучалина, следует выделить местный ИДС, обусловленный локальным действием повреждающих факторов - курения и загрязнения химическими выбросами воздуха на иммунный аппарат бронхо-легочной системы, алкоголя -на слизистую желудка, хронических воспалительных процессов в грудной железе и матке, незаживающих ран, язв, рубцов и пр. Bсe эти состояния могут рассматриваться как предрак и связаны, по нашим данным, с нарушением поступления и функционирования иммунных клеток в тканях вследствие нарушения микроциркуляции и развития гипоксии.ИДС - это не болезнь, а патологическое состояние, которое может длительно компенсироваться. В то же время оно является фактором риска тяжелейших социально значимых заболеваний, развитие которых провоцируется действием самых разных пусковых моментов. Ю. М. Лопухин указывал, что вторичный ИДС—одна из основных проблем патологии человека и играет более или менее значительную роль в возникновении и патогенезе большинства болезней. При этом в зависимости от конкретных особенностей сформировавшегося иммунного дефекта, преимущественного нарушения тех или иных регуляторных и эффекторных популяций и субпопуляций иммунных клеток, клиническая манифестация экологического СПИДа может быть различной. Л. В. Ковальчук показал доминирующее значение поражений Т-клеточного звена иммунной системы в формировании ИДС. Поэтому экологический СПИД характеризуется недостаточностью клеточной или сочетанием повреждения Т-клеточной и В-клеточной системы иммунитета. Наиболее типичным клиническим проявлением экологического СПИДа является снижение резистентности инфекции (особенно вирусной и грибковой). Характерна как подверженность к простудно-инфекционным заболеваниям, так и склонность к хронизации инфекции. Одна из форм реализации ИДС -развитие бластоматозного процесса. В других случаях, клинические проявления декомпенсированного ИДС могут заключаться в предрасположенности к аллергическим, аутоаллергическим заболеваниям. Разная клиническая манифестация ИДС обусловлена как особенностями патогенных факторов, вызвавших ИДС, так и особенностью экологических факторов и условий, трансформировавших это патологическое состояние в клинически выраженную болезнь. Прежде всего это связано с характером изменения соотношения Т-хелперов и Т-супрессоров (Л. В. Ковальчук, А. Н. Чередеев). В настоящее время имеются надежные возможности диагностирования ИДС, При этом может быть проведена глубокая оценка состояния иммунной системы с .определением самых разных ее показателей и параметров. Однако оценка, разных параметров часто дает противоречивые результаты. Поэтому остро встает вопрос о разработке ограниченного количества тестов, дающих целостное, интегративное представление о функции системы иммунитета. К тому же современные методы оценки иммунного статуса с использованием, например, моноклональных антител технически сложны, трудоемки, дорогостоящи, требуют импортных реактивов большой затраты времени. В настоящее время для иммуноэпидемиологических исследований принята двухэтапная методология оценки иммунного статуса. I этап включает клинико-иммунологическое обследование по стандартным анкетам с перечнем клинических признаков иммунологической недостаточности (ИН). II этап состоит из лабораторно-иммунологического исследования, проводимого по тестам оценки иммунного статуса, условно разделенным на первый и второй уровни (Р. В. Петров. Л. В. Ковальчук, А. Н. Чередеев), Безусловно, эта методология на сегоднашнем этапе отечественной клинической иммунологии является наиболее адекватной для иммунологических исследований населения, однако для скрининговых исследований ее применение затруднительно. Нерешенность и в то же время актуальность этой .проблемы побудила нас обратиться к методам пунктурной рефлексодиагностики, оснастив их современными техническими возможностями.Нами совместно с В. Г. Вограликом разработан новый метод экспресс -диагностики тимусзависимых ИДС (авторское свидетельство № 1420695), удобный для проведения массовых скрининговых исследований. Он заключается в том, что у испытуемых измеряют инфракрасное (ИК) излучение в области рукоятки грудины (акупунктурные точки XIV.20, 22) и на внутренней поверхности стопы проксимальнее головки первой .плюсневой кости (акупунктурная точка .IV. 2). При снижении температуры в этих зонах -на 0,4° С ниже сравнительно с прилежащими тканями больного относят в группу риска по вторичному Т-клеточному ИДС. Продолжительность исследования составляет 3—5 мин. Оно может .выполняться на отечественном быстродействующем тепловизоре марки “Электроника ТВ-03” (рис. 1 и 2). Метод основан на обнаруженных нами внешних механизмах регуляции иммунитета посредством рефлекторных влияний с определенных Mикрозон покровов тела и обратных реперкуторных влияний с органов иммуногенеза на эти участки покровов тела.Теоретической базой этого диагностического метода явилось открытие В. Г. Вограликом, М .В Вограликом и М. В. Головановой закономерного изменения ИК-излучення микрозон покровов тела в области акупунктурных точек, корреспондирующих патологически измененный орган, обусловленного .изменением микро-циркуляции и окислительных процессов в тканях в области акупунктурной точки, соответствующим изменению этих показателен в больном органе. Применительно к ИДС снижение ИК-излучения в указанных акупунктурных точках объясняется снижением микроциркуляции и окислительных процессов, развивающихся рефлектрно в ответ на аналогичные нарушения в органах иммуногенеза. Изучение связи выявленного феномена сниженного ИК излучения с иммунопатологическими синдромами проведено у 554 работников одного из предприятий Нижнего Новгорода в возрасте с 20 до 59 лет. Отмечалось резкое нарастание с возрастом клиниских признаков иммунологической недостаточности (хронические инфекционно-воспалительные заболевания, - аллергические, аутоиммунные болезни: хронические .заболевания сердечно-сосудистой системы, желудочно-кишечного тракта, обмена веществ) - 40,9% у лиц в возрасте 20—29 лет и до 78,5% у лиц в возрасте - 59 лет.При сопоставлении клинической оценки обследованных с данными тепловизионной диагностики установлены, казалось бы, как некоторая гиподиагностика. (около 10%), так и гипердиагностика около 15%) при тепловизионном исследовании. Однако при составлении результатов тепловизионной оценки иммунного статуса с данными лабораторных исследований выявлена их почти полная идентичность. В группе лиц с установленным методом тепловидения ИДС отмечалось статически достоверное снижение количества Т-лимфоцитов в крови (Е-РОК 32,2±2,4% или 418.6± 60,7 кл/мкл; в контроле: Е-РОК 51,8±0,92% или 1004± 0,50 кл/.мкл, р<0,001) и их функциональной активности (ПУМ: >,6±6,3%; в контроле: 63,3±2,3, р<0,05). Более того, определена статистически -достоверная обратная коррелятивная зависимость между локальным снижением (в градусах Цельсия) темгратуры в области акупунктурных точек на грудине (XIV. 20, !) и количеством Т-лимфоцитов в крови, имеющая следующее магематическое выражение; Е—РОК== 20,29868ХТ°гр.+36,11362. имеется аналогичная зависимость между количеством Т-лимфоятов и локальным снижением температуры в области акупунктурных точек стопы (IV.2). Ее математическое выражение:-.РОК == —13,55115ХТ°ст.+33,164699.Анализ .полученных данных показал, что п.ри тепловизионной гиподиагностике ИДС у больных имелись аллергические нарушеия неиммунного характера, при тепловизионной гипердиагностике сравнительно с клинической картиной у больных был ИДС состоянии компенсации. Для выяснения возможностей тепловизнонной рефлексодиагностики по оценке субпопуляционных отношений иммунных клеток сопоставлены исследования ИК-излучения акупунктурных точек с иммунологическими .исследованиями с использованием мооклональных антител ИКО—12, 31, 86, 90. Они выявляют соответственно В-клетки, клетки с супрессорным и хелперным фенотипом, общие Т-клётки. В итоге нами установлено, что величина температурного градиента на грудине коррелирует с процентным содержанием супрессорных клеток (г-т-0,609, р<0,00!). В связи с этим лри увеличении температурного градиента закономерно снижается соотношение Т-хелперы / Т-супрессоры (г между этим показателем и температурным градиентом на грудине равно 0.489, р<0,05). Известно, что снижение соотношения Т-хелперы / Т-супрессоры характерно для ИДС. Достоверная корреляция ямеется между температурным градиентом на стопах и содержанием Т-хелперов (г = —0,569, р<0,02).Таким образом, предложенный нами метод экспресс- диагностики ИДС с .помощью тепловидения является высокоинформативным и пригоден для скрининговых исследований населения.Коррекция иммунных нарушений у лиц с экологическим СП.ИДом представляет важнейшую медико-социальную проблему. Использование лекарственных .иммуностимуляторов ( в том числе препаратов тимуса) для этих целей малопригодно не только вследствие дефицитности и дороговизны, но и малого последействия этих средств. Более перспективно в этом случае применение адаптогенов (жень-шень, мумие, золотой корень, элеутерококк, особенно в сочетании с препаратами нуклеиновых кислот—А. А. Ярилин, A. iM. Смирнов и др.)..В пострадавших районах Белоруссии хороший эффект получен от лечения комбинацией витаминов с микроэлементами.Изучение патогенеза вторичных ИДС, к которым относится и экологический СПИД, позволило нам разработать метод пунктурной рефлексотерапии Т-клеточных ИДС, основанный на обнаружении и использовании как внешних, так и внутренних -механизмов регуляции системы иммунитета. Внешняя .регуляция органов иммуногенеза осуществляется со стороны окружающей среды через микрозоны покровов тела, функционально связанные с системой иммунитета. Эти микрозоны были открыты нами с помощью тепловиденяя. Они, как указывалось выше, локализуются в области акупунктурных точек XIV. 20, 22, iV. 2. Внутренняя регуляция иммуногенеза обеспечивается центрами гипоталамуса, гипофизом, щитовидной железой, надпочечниками (дающими иммунодепрессивный эффект только в случае чрезмерности инкреции глюкокортикостероидов). Она реализуется не только через медиаторы вегетативной нервной системы, но в значительной мере и за счет изменения микроциркуляции, кислородообеспечения и энергетического обмена иммунных органов н клеток. На все эти механизмы внутренней регуляции иммуногенеза также можно воздействовать рефлекторно с покровов тела через аурикулярные точки “гипоталамуса”, “щитовидной железы”, а также корпоральные точки 111.36, Х.5, регулирующие и стимулирующие, по нашим данным, микроциркуляцию и обладающие общеукрепляющим действием.Метод воздействия (возбуждающий или слабый тормозвой-нормализующий) выбран на основании оценки функционального состояния “точек воздействия”. Уже в течение первого курса иглорефлексотерапии (10 сеансов) удается достигнуть статистически доверного выраженного эффекта стимуляции системы иммунитета: у больных с исходно резким угнетением клеточного иммунитета показатели Е—РОК увеличились с 481 до 817,3±83 мкл, что соответствует нижней границе нормы; показатель угнетения миграции лейкоцитов (ПУМ), характеризующий функнальную активность Т-лимфоцитов, возрос с 22±4,5 до ±5,2% (при норме 40—80%); нормализовались кожные тесты гиперчувствительности замедленного типа на туберкулин, фитоагглютинин. Улучшение иммунных показателей коррелировало типическими показателями состояния больного, а также с данными тепловизионной экспресс-диагностики ИДС, Согревание холодной микрозоны в области акупунктурных точек грудины закономерно коррелирует с. нарастанием количества Т-лимфоцитов в крови. Выраженный эффект иглорефлексотерапии на систему иммунитета подтверждается нашими совместными с Е, Макаровой исследованиями с использованием моноклональных антител тбл1.
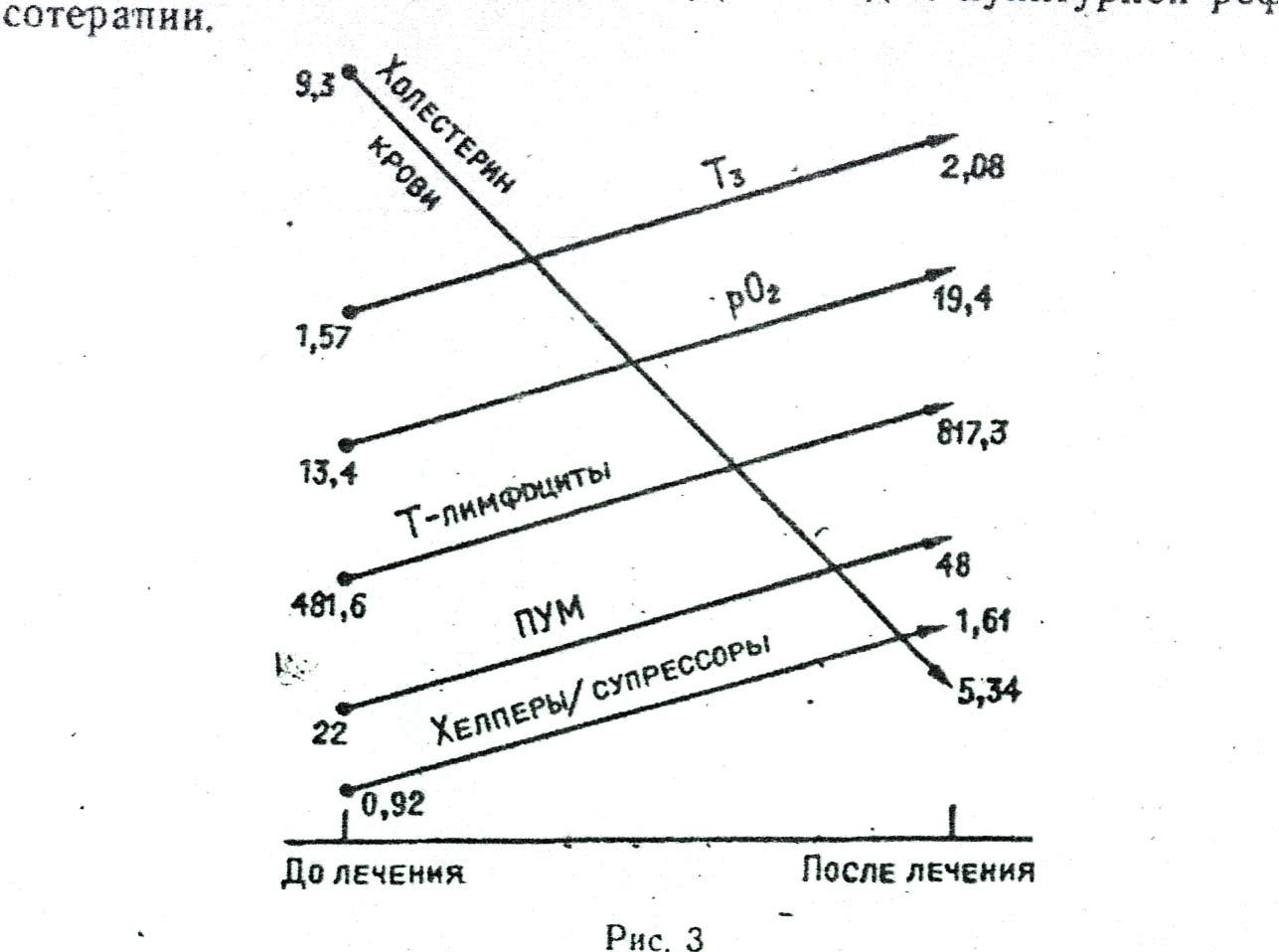
Как видно -из приведенной таблицы, в результате одного курса лечения происходит статистически достоверное снижение Т-супрессоров (ИКО-31), повышение содержания Т-хелперов (ИКО-86), вследствие чего нормализуется индекс регуляции иммунитета. Отмечалась также тенденция к повышению общего числа Т-лимфоцитов (ИКО-90). Одновременно существенно выравнивалась температура в области акупунктурных точек .грудины и стопы, корреопондкрующих систему иммунитета, по отношению к температуре прилежащих участков покровов тела.На рис. 3 представлены основные иммунные сдвиги и механизмы саногенеза при лечении ИДС -методом пунктурной рефлексотерапии.
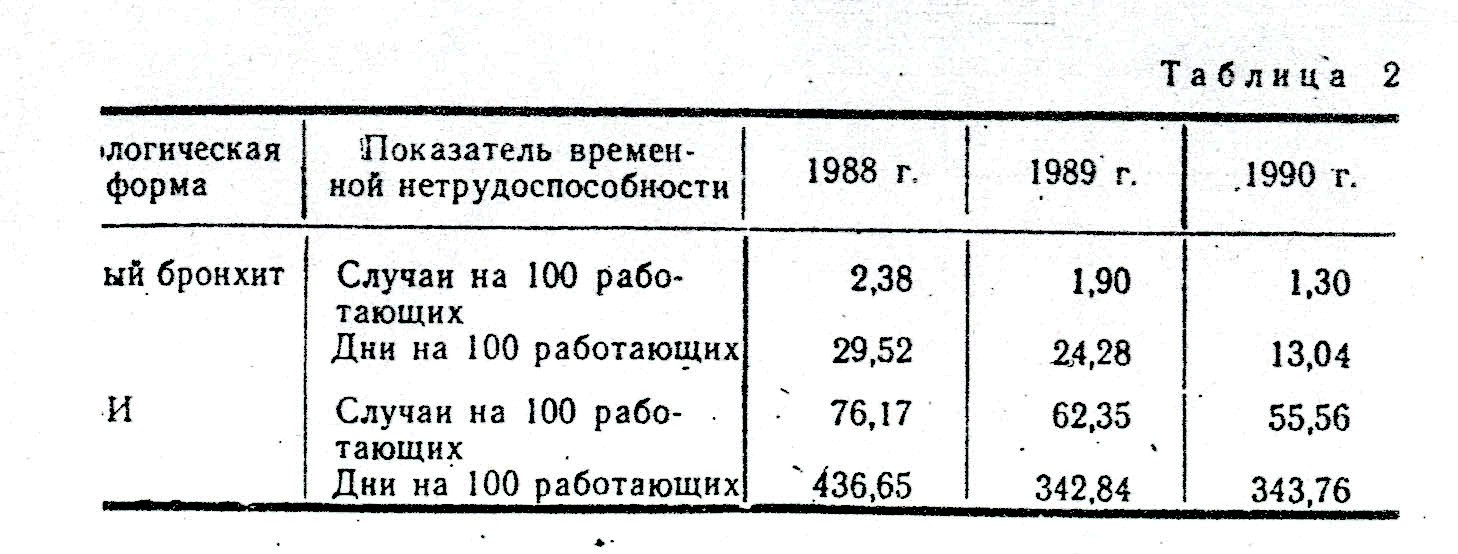
Большим достоинством пунктурной рефлексотерапии является длительное последействие -эффект сохраняется в течение полугода. Нами разработан план нормализации и стабилизации иммунного статуса у таких больных, включающий повторные — 2 раза в год—10-дневные курсы иглорефлексотерапии. Проанализированы показатели заболеваемости с временной утратой трудоспособности работников промышленного предприятия до и после лечения этим методом. В результате лечения 'временная нетрудоспособность за год существенно снизилась: количество заболеваний на 100 работающих снизилось с 153,3 до 86,6, -дни временной нетрудоспособности на 100 работающих—с 1266,6 до 519,9. Табл. 2 демонстрирует динамику снижения заболеваемости с временной утратой трудоспособности у иммунодефицитных лиц, получавших один раз в 6 месяцев курсы ИРТ, по двум нозологическим формам: острому бронхиту и острой респираторной вирусной инфекции (ОРВИ).
При всей эффективности и экономичности метод иглорефлексотерапии при массовом лечении больных (а также и должно быть при лечении больных экологическим СПИДом) встречает определенные технические трудности - необходимы специальная подготовка врачей -иглорефлексотерапевтов, огромное количество пунктурных игл, их постоянная стерилизация и пр. Поэтому замена его методом неинвазивной пунктурной терапии, равноценной по эффективности, имеет огромный смысл. Нами с участием Макаровой разработан способ иммунокоррекции при экологическом СПИДе путем воздействия на перечисленные а.купунктурные точки .инфракрасным -когерентным светом, генерируемым инфракрасным светодиодом. П.рибор для реализации такого лечебного воздействия, разработанный в клинике В. Г. Вогралика, прошел испытания и производится серийно. Воздействие лишено какого-либо побочного действия. Процедура может выполняться самим больным по указаниям врача.Все вышесказанное свидетельствует о больших возможностях рефлексодиагностики и пунктурной рефлексотералии в решении проблемы экологического СПИДа. Эти методы должны занять достойное место в практике здравоохранения. Эволюция формировала систему иммунитета около 500 млн. лет. Этот шедевр природы восхищает нас красотой гармонии и целесообразностью. Настойчивое любопытство ученых разных специальностей раскрыло перед нами закономерности ее функционирования и создало в последние 110 лет науку “Медицинская иммунология”.
МЕХАНИЗМЫ ИММУНОЛОГИЧЕСКОЙ ЗАЩИТЫ ОРГАНИЗМА. Начало развития иммунологии относится к концу XVIII века и связано с именем Э. Дженнера, впервые применившего на основании лишь практических наблюдений впоследствии обоснованный теоретически метод вакцинации против натуральной оспы. Открытый Э. Дженнером факт лег в основу дальнейших экспериментов Л. Пастера, завершившихся формулировкой принципа профилактики от инфекционных заболеваний - принцип иммунизации ослабленными или убитыми возбудителями. Развитие иммунологии долгое время происходило в рамках микробиологической науки и касалось лишь изучения невосприимчивости организма к инфекционным агентам. На этом пути были достигнуты большие успехи в раскрытии этиологии ряда инфекционных заболеваний. Практическим достижением явилась разработка методов диагностики, профилактики и лечения инфекционных заболеваний в основном путем создания различного рода вакцин и сывороток. Многочисленные попытки выяснения механизмов, обусловливающих устойчивость организма против возбудителя, увенчались созданием двух теорий иммунитета - фагоцитарной, сформулированной в 1887 году И. И. Мечниковым, и гуморальной, выдвинутой в 1901 году П. Эрлихом. Начало XX века - время возникновения другой ветви иммунологической науки - иммунологии неинфекционной. Как отправной точкой для развития инфекционной иммунологии явились наблюдения Э. Дженнера, так для неинфекционной - обнаружение Ж. Борде и Н. Чистовичем факта выработки антител в организме животного в ответ на введение не только микроорганизмов, а вообще чужеродных агентов. Свое утверждение и развитие неинфекционная иммунология получила в созданном И. И. Мечниковым в 1900 г. учении о цитотоксинах - антителах против определенных тканей организма, в открытии К. Ландштейнером в 1901 году антигенов человеческих эритроцитов. Результаты работ П. Медавара (1946) расширили рамки и привлекли пристальное внимание к неинфекционной иммунологии, объяснив, что в основе процесса отторжения чужеродных тканей организмом лежат тоже иммунологические механизмы. И именно дальнейшее расширение исследований в области трансплантационного иммунитета привлекло к открытию в 1953 году явления иммунологической толерантности - неотвечаемости организма на введенную чужеродную ткань. Таким образом, даже краткий экскурс в историю развития иммунологии позволяет оценить роль этой науки в решении ряда медицинских и биологических проблем. Инфекционная иммунология - прародительница общей иммунологии - стала в настоящее время только ее ветвью. Стало очевидным, что организм очень точно различает ”свое” и “чужое”, а в основе реакций, возникающих в нем в ответ на введение чужеродных агентов (вне зависимости от их природы), лежат одни и те же механизмы. Изучение совокупности процессов и механизмов, направленных на сохранение постоянства внутренней среды организма от инфекций и других чужеродных агентов - иммунитета, лежит в основе иммунологической науки (В. Д. Тимаков, 1973 г.). Вторая половина ХХ века ознаменовалась бурным развитием иммунологии. Именно в эти годы была создана селекционно-клональная теория иммунитета, вскрыты закономерности функционирования различных звеньев лимфоидной системы как единой и целостной системы иммунитета. Одним из важнейших достижений последних лет явилось открытие двух независимых эффекторных механизмов в специфическом иммунном ответе. Один из них связан с так называемыми В-лимфоцитами, осуществляющими гуморальный ответ (синтез иммуноглобулинов), другой - с системой Т-лимфоцитов (тимусзависимых клеток), следствием деятельности которых является клеточный ответ (накопление сенсибилизированных лимфоцитов). Особенно важным является получение доказательств существования взаимодействия этих двух видов лимфоцитов в иммунном ответе. Результаты исследований позволяют утверждать, что иммунологическая система - важное звено в сложном механизме адаптации человеческого организма, а его действие в первую очередь направленно на сохранение антигенного гомеостаза, нарушение которого может быть обусловленно проникновение в организм чужеродных антигенов (инфекция, трансплантация) или спонтанной мутации. Но, как показали исследования последних лет, деление иммунитета на гумморальный и клеточный весьма условно. Дейтсвительно, влияние антигена на лимфоцит и ретикулярную клетку осуществляется с помощью микро- и макрофагов, перерабатывающих иммунологическую информацию. В то же время реакция фагоцитоза, как правило, участвуют гуморальные факторы, а основу гуморального иммунитета составляют клетки, продуцирующие специфические иммуноглобулины. Механизмы, направленные на элиминацию чужеродного агента, чрезвычайно разнообразны. При этом можно выделить два понятия - “иммунологическая реактивность” и “неспецифические факторы защиты”. Под первым понимаются специфические реакции на антигены, обусловленные высокоспецифической способностью организма реагировать на чужеродные молекулы. Однако защищенность организма от инфекций зависит еще и от степени проницаемости для патогенных микроорганизмов кожных и слизистых покровов, и наличия в их секретах бактерицидных субстанций, кислотности желудочного содержимого, присутствия в биологических жидкостях организма таких ферментных систем, как лизоцим. Все эти механизмы относятся к неспецифическим факторам защиты, так как нет никакого специального реагирования и все они существуют вне зависимости от присутствия или отсутствия возбудителя. Некоторое особое положение занимают фагоциты и система комплемента. Это обусловлено тем, что, несмотря на неспецифичность фагоцитоза, макрофаги участвуют в переработке антигена и в кооперации Т- и В-лимфоцитов при иммуном ответе, то есть участвуют в специфических формах реагирования на чужеродные субстанции. Аналогично выработка комплемента не является специфической реакцией на антиген, но сама система комплемента участвует в специфических реакциях антиген-антител. ИММУНИТЕТ. ОРГАНЫ ИММУННОЙ СИСТЕМЫ. Логика подсказывает, что система иммунитета защищает нас от инфекционных агентов: бактерий, вирусов и простейших, т. е. защищает организм от всего чужеродного. Но, в то же время стало понятным, что иммунная система необходима, в первую очередь, для защиты от своего, ставшего чужим. Дело в том, что ежедневно в нашем организме возникают миллионы мутантных клеток, которые могут стать источником смертельных опухолей. Различают специфическую защиту, или иммунитет, и неспецифическую резистентность организма. Последняя в отличие от иммунитета направлена на уничтожение любого чужеродного агента. К неспецифической резистентности относятся фагоцитоз и пиноцитоз, система комплемента, естественная цитотоксичность, действие интерферонов, лизоцима, b-лизинов и других гуморальных факторов защиты. Иммунитет – это комплекс реакций, направленных на поддержание гомеостаза при встрече организма с агентами, которые расцениваются как чужеродные, независимо от того, образуются ли они в самом организме или поступают в него извне. Чужеродные для данного организма соединения, способные вызывать иммунный ответ, получили название “антигены” (АГ). Теоретически любая молекула может быть АГ. В результате действия АГ в организме образуются антитела (АТ), сенсибилизируются лимфоциты, благодаря чему они приобретают способность принимать участие в иммунном ответе. Специфичность АГ заключается в том, что он избирательно реагирует с определенными АТ или лимфоцитами, появляющимися после попадания АГ в организм. Способность АГ вызывать специфический иммунный ответ обусловлена наличием на его молекуле многочисленных детерминант (эпитонов), к которым специфически, как ключ к замку, подходят активные центры (антидетерминанты) образующихся АТ. АГ, взаимодействуя со своими АТ, образуют иммунные комплексы. Как правило, АГ – это молекулы с высокой молекулярной массой; существуют потенциально активные в иммунологическом отношении вещества, величина молекулы которых соответствует одной отдельной антигенной детерминанте. Такие молекулы носят наименование гаптенов. Последние способны вызывать иммунный ответ, только соединяясь с полным АГ, т. е. белком. Органы, принимающие участие в иммунитете, делят на 4 группы: 1. Центральные – тимус, или вилочковая железа, и, по-видимому, костный мозг. 2. Периферические, или вторичные, - лимфатические узлы, селезенка, система лимфоэпителиальных образований, расположенных в слизистых оболочках различных органов. 3. Забарьерные ЦНС, семенники, глаза, паренхима тимуса и при беременности – плод. 4. Внутрибарьерные – кожа.
Различают клеточный и гуморальный иммунитет. Клеточный иммунитет направлен на уничтожение чужеродных клеток и тканей и обусловлен действием Т-киллеров. Типичным примером клеточного иммунитета является реакция отторжения чужеродных органов и тканей, в частности кожи, пересаженной от человека человеку. Гуморальный иммунитет обеспечивается образованием АТ и обусловлен в основном функцией В-лимфоцитов.
ИММУННЫЙ ОТВЕТ В иммунном ответе принимают участие иммунокомпетентные клетки, которые могут быть разделены на антигенпрезентирующие (представляющие АГ), регуляторные (регулирующие течение иммунных реакций) и эффекторы иммунного ответа (осуществляющие заключительный этап в борьбе с АГ). К антигенпрезентирующим клеткам относятся моноциты и макрофаги, эндотелиальные клетки, пигментные клетки кожи (клетки Лангерганса) и др. К регуляторным клеткам относятся Т- и В- хелперы, супрессоры, контрсупрессоры, Т-лимфоциты памяти. Наконец, к эффекторам иммунного ответа принадлежат Т- и В-киллеры и В-лимфоциты, являющиеся в основном антителопродуцентами. Важная роль в иммунном ответе отводится особым цитокинам, получившим наименование интерлейкинов. Из названия видно, что ИЛ обеспечивают взаимосвязь отдельных видов лейкоцитов в иммунном ответе. Они представляют собой малые белковые молекулы с молекулярной массой 15000-30000.
ИЛ-1 – соединение, выделяемое при антигенной стимуляции моноцитами, макрофагами и другими антигенпрезентирующими клетками. Его действие в основном направлено на Т-хелперы (амплифайеры) и макрофаги-эффекторы. ИЛ-1 стимулирует гепатоциты, благодаря чему в крови возрастает концентрация белков, получивших наименование ректантов острой фазы, так как их содержание всегда увеличивается в острую фазу воспаления. К таким белкам относятся фибриноген, С-реактивный белок, a1-антитрипсин и др. Белки острой фазы воспаления играют важную роль в репарации тканей, связывают протеолитические ферменты, регулируют клеточный и гуморальный иммунитет. Увеличение концентрации ректантов острой фазы является приспособительной реакцией, направленной на ликвидацию патологического процесса. Кроме того, ИЛ-1 усиливает фагоцитоз, а также ускоряет рост кровеносных сосудов в зонах повреждения.
ИЛ-2 выделяется Т-амплифайерами под воздействием ИЛ-1 и АГ; является стимулятором роста для всех видов Т-лимфоцитов и активатором К-клеток.
ИЛ-3 выделяется стимулированными Т-хелперами, моноцитами и макрофагами. Его действие направлено преимущественно на рост и развитие тучных клеток и базофилов, а также предшественников Т- и В- лимфоцитов.
ИЛ-4 продуцируется в основном стимулированными Т-хелперами и обладает чрезвычайно широким спектром действия, так как способствует росту и дифференцировке В-лимфоцитов, активирует макрофаги, Т-лимфоциты и тучные клетки, индуцирует продукцию иммуноглобинов отдельных классов.
ИЛ-5 выделяется стимулированными Т-хелперами и является фактором пролиферации и дифференцировки эозинофилов, а также В-лимфоцитов.
ИЛ-6 продуцируется стимулированными моноцитами, макрофагами, эндотелием, Т-хелперами и фибробластами; вместе с ИЛ-4 обеспечивает рост и дифференцировку В-лимфоцитов, способствуя их переходу в антителопродуценты, т. е. плазматические клетки.
ИЛ-7 первоначально выделен из стромальных клеток костного мозга; усиливает рост и пролиферацию Т- и В- лимфоцитов, а также влияет на развитие тимоцитов в тимусе.
ИЛ-8 образуется стимулированными моноцитами и макрофагами. Его назначение сводится к усилению хемотаксиса и фагоцитарной активности нейтрофилов.
ИЛ-9 продуцируется Т-лимфоцитами и тучными клетками. Действие его направлено на усиление роста Т- лимфоцитов. Кроме того, он способствует развитию эритроидных колоний в костном мозге.
ИЛ-10 образуется макрофагами и усиливает пролиферацию зрелых и незрелых тимоцитов, а также способствует дифференцировке Т-киллеров.
ИЛ-11 продуцируется стромальными клетками костного мозга. Играет важную роль в гемопоэзе, особенно тромбоцитопоэзе.
ИЛ-12 усиливает цитотоксичность Т-киллеров и К-лимфоцитов. Иммунный ответ начинается с взаимодействия антигенпрезентирующих клеток с АГ, после чего происходит его фагоцитоз и переработка до продуктов деградации, которые выделяются наружу и оказываются за пределами антигенпрезентирующей клетки. Специфичность иммунного ответа обеспечивается наличием особых антигенов, получивших у мышей название Ia-белка. У человека его роль выполняют человеческие лейкоцитарные антигены 2-го класса, тип DR (Human Leukocytes Antigens, HLA). Ia-белок находится практически на всех кроветворных клетках, но отсутствует на зрелых Т- лимфоцитах; под влиянием интерлейкинов происходит экспрессия белка на этих клетках. Роль Ia-белка в иммунном ответе сводится к следующему. АГ могут быть распознаны иммунокомпетентными клетками лишь при контакте со специфическими рецепторами, однако количество АГ слишком велико и природа не заготовила для них соответствующего числа рецепторов, вот почему АГ (чужое) может быть узнан лишь в комплексе со “своим”, функцию которого и несет Ia- белок или антигены HLA-DR. Продукты деградации АГ, покинув макрофаг, частично вступают во взаимодействие с Ia- белком, образуя с ним комплекс, стимулирующий деятельность антигенпрезентирующей клетки. При этом макрофаг начинает секретировать ряд интерлейкинов. ИЛ-1 действует на Т-амплифайер, в результате чего у последнего появляется рецептор к комплексу Ia-белок+АГ. Именно эта реакция, как и все последующие, обеспечивает специфичность иммунного ответа. Активированный Т-амплифайер выделяет ИЛ-2, действующий на различные клоны Т- хелперов и цитотоксические лимфоциты, принимающие участие в клеточном иммунитете. Стимулированные клоны Т-хелперов секретируют ИЛ-3, ИЛ-4, ИЛ-5 и ИЛ-6, оказывающие преимущественное влияние на эффекторное звено иммунного ответа и тем самым способствующие переходу В-лимфоцитов в антителопродуценты. Благодаря этому образуются АТ, или иммуноглобины. Другие интерлейкины (ИЛ-7, ИЛ- 9, ИЛ-10, ИЛ-12) влияют нарост и дифференцировку Т- и В-лимфоцитов и являются факторами надежности, обеспечивающими иммунный ответ. Клеточный иммунитет зависит от действия гуморальных факторов, выделяемых цитотоксическими лимфоцитами (Т-киллерами). Эти соединения получили наименование “перфорины” и “цитолизины”. Установлено, что каждый Т-эффектор способен лизировать несколько чужеродных клеток- мишеней. Этот процесс осуществляется в три стадии: 1) распознавание и контакт с клетками-мишенями; 2) летальный удар; 3) лизис клетки-мишени. Последняя стадия не требует присутствия Т-эффектора, так как осуществляется под влиянием перфоринов и цитолизинов. В стадию летального удара перфорины и цитолизины действуют на мембрану клетки-мишени и образуют в ней поры, через которые проникает вода, разрывающая клетки. Среди гуморальных факторов, выделяемых в процессе иммунного ответа, следует указать на фактор некроза опухолей и интерфероны. Действие интерферонов неспецифично, так как они обладают различными функциями – стимулируют деятельность К-клеток и макрофагов, влияют непосредственно на ДНК - и РНК-содержащие вирусы, подавляя их рост и активность, задерживают рост и разрушают злокачественные клетки. Гуморальный иммунный ответ обеспечивается антителами, или иммуноглобинами. У человека различают 5 основных классов иммуноглобинов: IgA, IgG, IgM, IgE, IgD. Все они имеют как общие, так и специфические детерминанты.
Иммуноглобины класса G. У человека являются наиболее важными. Концентрация их достигает 9-18 г/л. Иммуноглобины этого класса обеспечивают противоинфекционную защиту, связывают токсины, усиливают фагоцитарную активность, активируют систему комплемента, вызывают аглютинацию бактерий и вирусов, они способны переходить через плаценту, обеспечивая новорожденному так называемый пассивный иммунитет.
Иммуноглобины класса А. Делят на 2 разновидности: сывороточные и секреторные. Первые из них находятся в крови, вторые – в различных секретах. Соответственно этому сывороточный иммуноглобин А принимает участие в общем, иммунитете, а секреторный обеспечивает местный иммунитете, создавая барьер на пути проникновения инфекций и токсинов в организм.
Секреторный иммуноглобулин находится в наружных секретах – в слюне, слизи трахеобронхиального дерева, мочеполовых путей, молоке. Молекулы иммуноглобина А, присутствующие во внутренних секретах и жидкостях, существенно отличаются от молекул наружных секретов. Секреторный компонент, по всей видимости, образуется в эпителиальных клетках и в дальнейшем присоединяется к молекуле IgA.
IgA нейтрализует токсины и вызывает аглютинацию микроорганизмов и вирусов. Концентрация сывороточных IgAколеблется от 1,5 до 4 г/л.
Содержание IgA резко возрастает при заболеваниях верхних дыхательных путей, пневмониях, инфекционных заболеваниях желудочно-кишечного тракта и др.
Иммуноглобины класса Е. Принимают участие в нейтрализации токсинов, опсонизации, аглютинации и бактериолизисе, осуществляемом комплементом. К этому классу также относятся некоторые природные антитела, например к чужеродным эритроцитам. Содержание IgEповышается при инфекционных заболеваниях у взрослых и детей.
Иммуноглобины класса D. Представляют собой антитела, локализующиеся в мембране плазматических клеток, в сыворотке их концентрация невелика. Значение IgD пока не выяснено, предполагают, что они участвуют в аутоиммунных процессах.
РЕГУЛЯЦИЯ ИММУНИТЕТА Интенсивность иммунного ответа во многом определяется состоянием нервной и эндокринной систем. Установлено, что раздражение различных подкорковых структур (таламус, гипоталамус, серый бугор) может сопровождаться как усилением, так и торможением иммунной рекции на введение антигенов. Показано, что возбуждение симпатического отдела автономной (вегетативной) нервной системы, как и введение адреналина, усиливает фагоцитоз и интенсивность иммунного ответа. Повышение тонуса парасимпатического отдела вегетативной нервной системы приводит к противоположным реакциям. Стресс, а также депрессии угнетают иммунитет, что сопровождается не только повышенной восприимчивостью к различным заболеваниям, но и создает благоприятные условия для развития злокачественных новообразований. За последние годы установлено, что гипофиз и эпифиз с помощью особых пептидных биорегуляторов, получивших наименование “цитомедины”, контролируют деятельность тимуса. Передняя доля гипофиза является регулятором преимущественно клеточного, а задняя – гуморального иммунитета.
ИММУННАЯ РЕГУЛЯТОРНАЯ СИСТЕМА В последнее время высказано предположение, что существует не две системы регуляции (нервная и гуморальная), а три (нервная, гуморальная и иммунная). Иммунокомпетентные клетки способны вмешиваться в морфогенез, а также регулировать течение физиологических функций. Не подлежит сомнению, что Т-лимфоциты играют чрезвычайно важную роль в регенерации тканей. Многочисленные исследования показывают, что Т-лимфоциты и макрофаги осуществляют “хелперную” и “супрессорную” функции в отношении эритропоэза и лейкопоэза. Лимфокины и монокины, выделяемые лимфоцитами, моноцитами и макрофагами, способны изменять деятельность центральной нервной системы, сердечно-сосудистой системы, органов дыхания и пищеварения, регулировать сократительные функции гладкой и поперечно-полосатой мускулатуры. Особенно важная роль в регуляции физиологических функций принадлежит интерлейкинам, которые являются “семьей молекул на все случаи жизни”, так как вмешиваются во все физиологические процессы, протекающие в организме. Иммунная система является регулятором гомеостаза. Эта функция осуществляется за счет выработки аутоантител, связывающих активные ферменты, факторы свертывания крови и избыток гормонов. Иммунологическая реакция, с одной стороны, является неотъемлемой частью гуморальной, так как большинство физиологических и биохимических процессов осуществляется при непосредственном участии гуморальных посредников. Однако нередко иммунологическая реакция носит прицельный характер и тем самым напоминает нервную. Лимфоциты и моноциты, а также другие клетки, принимающие участие в иммунном ответе, отдают гуморальный посредник непосредственно органу-мишени. Отсюда предложение назвать иммунологическую регуляцию клеточно-гуморальной. Основную роль в ней следует отвести различным популяциям Т-лимфоцитов, осуществляющих “хелперные” и “супрессорные” функции по отношению к различным физиологическим процессам. Учет регуляторных функций иммунной системы позволяет врачам различных специальностей по-новому подойти к решению многих проблем клинической медицины.Интерес к иммуностимулирующей терапии, имеющей длительную историю, резко возрос в последние годы и связан с проблемами инфекционной патологии и онкологии. Специфическое лечение и профилактика, основанная на вакцинации, действенны при ограниченном числе инфекций. При таких инфекциях, как кишечные и грипп, эффективность вакцинации остается недостаточной. Высокий процент смешанных инфекций, полиэтиологичность многих делают создание специфических препаратов для иммунизации против каждого из возможных возбудителей не реальным. Введение сывороток или иммунных лимфоцитов оказывается эффективным только на ранних этапах инфекционного процесса. Кроме того, сами вакцины в определенные фазы иммунизации способны подавлять сопротивляемость организма к инфекциям. Также известно, что в связи с быстрым увеличением числа возбудителей, обладающих множественной устойчивостью к антимикробным средствам, с высокой частотой ассоциированных инфекций, резким повышением иммунизации способны подавлять сопротивляемость организма к L-формам бактерий и значительным количеством серьезных осложнений эффективная антибиотикотерапия становится все более сложной. Течение инфекционного процесса осложняется, а трудности терапии существенно усугубляются при поражении иммунной системы и механизмов неспецифической защиты. Эти нарушения могут быть генетически обусловлены или же возникают вторично под влиянием разнообразных факторов. Все это делает актуальной проблему иммуностимулирующей терапии. С широким введением асептики, обеспечивающей предупреждение занесения микроорганизмов в операционную рану, началась научно обоснованная профилактика инфекций в хирургии. Прошло всего восемьдесят шесть лет, а учение об инфекции в хирургии проделало большой и сложный путь. Открытие и широкое применение антибиотиков обеспечили надежную профилактику нагноений операционных ран. Клиническая иммунология - молодой раздел медицинской науки, но уже первые результаты ее применения в профилактике и лечении открывают широкие перспективы. Пределы возможностей клинической иммунологии полностью предвидеть пока трудно, но уже сейчас с уверенностью можно сказать - в этом новом разделе науки врачи приобретают могучего союзника в профилактике и лечении инфекций.. 2.Иммуномоделирующие средства. Иммуномоделирующими средствами являются препараты химической или биологической природы, способные модулировать (стимулировать или подавлять) реакции иммунитета в результате воздействия на иммунокомпетентные клетки, на процессы их миграции или на взаимодействие таких клеток или их продуктов.2.1. Полисахариды Число сообщениий об изучении различных липополисахаридов (ЛПС) продолжает стремительно нарастать. Особенно интенсивно изучаются ЛПС грамнегативных бактерий, в оболочке которых содержится до 15-40% ЛПС. Полисахаридные препараты, в последнее время левамизол, вызывают большой интерес среди средств неспецифической иммуностимулирующей терапии. Большинство ЛПС из-за их высокой токсичности и обилия побочных эффектов неприемлемы для клинического использования, но являются ценным средством иммунологического анализа. Но ЛПС очень активны и имеют широкий спектр иммуномодулирующгео действия, и поэтому идет постоянный поиск новых, менее токсичных ЛПС. Доказательством этого является синтез сальмозана, который представляет собой полисахаридные фракции самотического О-антигена бактерии брюшного тифа. Он малотоксичен, практически не содержит белков и липидов. В экспериментах на мышах доказано, что при парентеральном введении сальмозан является стимулятором пролиферации и дифференцировки стволовых клеток, стимулирует образование антител, фагоцитарную активность лейкоцитов и макрофагов, повышает титр лизоцима в крови, стимулирует неспецифическую резистентность к инфекциям. Исследования последних лет доказывают, что полисахариды и полисахаридные комплексы - не единственные компоненты бактериальной клетки, способные стимулировать иммунитет. Но из бактериальных полисахаридов в медицине в настоящее время более широко применяются пирогенал и продигиозан. Пирогенал: препарат, который давно вошел в арсенал средств неспецифической иммуностимулирующей терапии. Он вызывает кратковременную (несколько часов) лейкопению, сменяющуюся лейкоцитозом, и повышает фагоцитарную функцию лейкоцитов. В организации неспецифической защиты против инфекции основное значение пирогенала связано с активацией фагоцитоза. Как и другие ЛПС, пирогенал проявляет адъювантные свойства, повышая иммунный ответ к различным антигенам. Мобилизация фагоцитарных механизмов, стимуляция образования антител, гуморальных неспецифических факторов защиты может быть причиной повышения антиинфекционной резистентности под влиянием пирогенала. Но это зависит от времени воздействия пирогенала по отношению к моменту заражения, дозы, чистоты введения. Но при острых инфекционных заболеваниях пирогенал не применяется из-за мощного пирогенного эффекта, хотя лихорадка увеличивает резистентность организма к ряду инфекций, вызывая благоприятные метаболические и иммунологические сдвиги. Основная клиническая область использования пирогенала как средства неспецифической иммуностимулирующей терапии - хронические инфекционно- воспалительные заболевания. Накоплен значительный опыт применения пирогенала в комплексной терапии туберкулеза (вместе с антибактериальными препаратами): ускоряется закрытие полостей распада у больных, у которых впервые выявлен туберкулез легких, и улучшает клиническое течение заболевания у больных, ранее безуспешно леченных только антибактериальными средствами. Наибольшую активность отмечают при кавернозной, инфильтративной форме туберкулеза легких. Способность пирогенала стимулировать антибиотикотерапию, по-видимому связано с противовоспалительным, сенсибилизирующим, фибринолитическим эффектами, с усилением регенеративных процессов в тканях. О перспективах применения пирогенала в онкологии свидетельствуют экспериментальные наблюдения: препарат уменьшает прививаемость и задерживает рост опухоли, усиливает противоопухолевую активность лучевой и химиотерапии. Сведения о применении пирогенала как антиаллергического средства очень противоречивы. Он эффективен при некоторых кожных заболеваниях. Но усиливает проявление анафилактического шока, феномена Артюса и Шварцмана. Будучи индуктором интерферона пирогенал снижает резистентность к вирусным инфекциям - прямое противопоказание при диагностировании гриппа. Продигиозан: самый яркий и важный эффект - это неспецифическое повышение устойчивости организма к инфекциям. Кроме высокой эффективности при генерализованных инфекциях, продигиозан оказывает действие и при локальных гнойно-воспалительных процессах, ускоряет ликвидацию инфекции, продуктов некротического распада, рассасывания воспалительного эксссудата, заживление поврежденных тканей, способствует восстановлению функций органов. Весьма важно то, что продигиозан увеличивает эффект антибиотиков при использовании субэффективных доз антибиотиков и при инфекциях, вызванных антибиотикоустойчивыми штаммами. Продигиозан, как и другие ЛПС, прямым действием на микроорганизмы не обладает. Повышение устойчивости к инфекциям целиком обусловлено антиинфекционными механизмами макроорганизма. Увеличение резистентности наступает через четыре часа после инъекции, достигает максимума через сутки, затем снижается. но остается на достаточном уровне в течение недели. Действие продигиозана основано: а) на энергичной мобилизации фагоцитарной активности макрофагов и лейкоцитов; б) на увеличении их числа; в) на усилении поглотительной и переваривающей функции; г) на увеличении активности лизосомальных ферментов; д) на том, что максимум фагоцитарной активности лейкоцитов удерживается дольше, чем лейкоцитоз: числа лейкоцитов в периферической крови возвращается в норму на первые- вторые сутки, а активность - лишь к третьим суткам; е) на увеличении опсонизирующего действия сыворотки крови. Путь действия продигиозана: стимуляция макрофагов продигиозаном - монокины - лимфоциты - лимфокины - активация макрофагов. О влиянии продигиозана на Т- и В- системы иммунитета информации мало. Продигиозан позитивно влияет на клиническое течение ряда заболеваний и улучшает иммунологические показатели (бронхолегочные заболевания, туберкулез, хронический остеомиелит, афтозный стоматит, дерматозы, тонзиллит, лечение и профилактика респираторных вирусных инфекций у детей). Например, применение продигиозана на ранних этапах острой пневмонии с вялотекущим течением - средство профилактики хронизации процесса; продигиозан способствует снижению степени выраженности аллергических реакций, заболеваемости ангиной в четыре раза у больных хроническим тонзиллитом, снижает частоту острых респираторных заболеваний в два-три раза. 2.2 Препараты нуклеиновых кислот и синтетические полинуклеотиды В последние годы возрос интерес к адъювантам полианионной природы в связи с интенсивным поиском иммуностимуляторов. Впервые нуклеиновые кислоты стали применять в 1882 году по инициативе Горбачевского при инфекционных заболеваниях стрепто- и стафиллококкового происхождения. В 1911 году Черноруцкий установил, что под влиянием дрожжевой нуклеиновой кислоты увеличивается количество иммунных тел. Нуклеинат натрия:увеличивает фагоцитарную активность, активирует поли- и мононуклеары, увеличивает эффективность тетрациклинов при смешанной инфекции, вызванной стафиллококком и синегнойной палочкой. При профилактическом введении нуклеинат натрия обусловливает и противовирусный эффект, так как обладает интерфероногенной активностью. Нуклеинат натрия ускоряет формирование прививочного иммунитета, увеличивает его качество, позволяет уменьшить дозу вакцины. Этот препарат оказывает позитивный эффект при лечении больных с хроническим паротитом, язвенной болезнью, различными формами пневмонии, хроническим воспалением легких, бронхиальной астмой. Нуклеинат натрия увеличивает содержание РНК и белка в макрофагах в 1,5 раза и гликогена в 1,6 раза, увеличивает активность лизосомальных ферментов, следовательно увеличивает завершенность фагоцитоза макрофагами. Препарат увеличивает содержание у человека лизоцима и нормальных антител, если их уровень был снижен. Особое место среди препаратов нуклеиновых кислот занимает иммунная РНК макрофагов, которая представляет собой информационную РНК, которая вносит в клетку фрагмент антигена, следовательно, идет неспецифическая стимуляция иммунокомпетентных клеток нуклеотидами. Неспецифическими стимуляторами являются синтетические двухцепочечные полинуклеотиды, которые стимулируют антителообразование, увеличивают антигенный эффект неиммуногенных доз антигена, обладающего антивирусными свойствами, связанными с интерфероногенной активностью. Их механизм действия сложен и недостаточно выяснен. Двунитчатая РНК включается в систему регуляции синтеза белка в клетке, активно взаимодействуя с клеточной мембраной. Но высокая стоимость препаратов, недостаточная их эффективность, наличие побочных явлений (тошнота, рвота, снижение артериального давления, увеличение температуры тела, нарушение функций печени, лимфопения - из-за прямого токсического действия на клетки), отсутствие схем использования делают применение препаратов ограниченным. 2.3 Производные пиримидина и пурина. В качестве средств, повышающих резистентность организма к инфекциям, с каждым годом все шире применяются производные пиримидина и пурина. Огромная заслуга в изучении производных пиримидина принадлежит Н. В. Лазареву, который более 35 лет назад первым пришел к мысли о необходимости средств, ускоряющих процессы регенерации. Производные пиримидина интересны тем, что они обладают низкой токсичностью, стимулируют белковый и нуклеиновый обмен, ускоряют клеточный рост и размножение, вызывают противоспалительные действия. Наибольшее распространение в качестве стимулятора антиинфекционной резистентности получил метилурацил, который стимулирует лейкопоэз, эритропоэз. Производные пиримидина способны предупреждать снижение фагоцитарной активности лейкоцитов, которое наступает под влиянием антибиотиков, вызывают индукцию синтеза интерферона, увеличивают уровень иммунизации, уровень нормальных антител. Механизм их действия как стимуляторов иммуногенеза, по-видимому, связан с включением их в белковый и нуклеиновый обмен, вызывающим поливалентное влияние на иммуногенез и процессы регенерации. В клинике применяется в терапии туберкулеза, хронической пневмонии, лепры, рожи, ожоговой болезни. Например, включение метилурацила в комплексную терапию дизентерии, который способствует нормализации показателей естественной резистентности (комплемент, лизоцим, b-лизин сыворотки, фагоцитарная активность). Иммуностимуляторами также являются производные пурина: мерадин, 7- изоприназин, 9-метиладенин. Изоприназин является одним из новых иммуностимулятров, который относится к иммуномодуляторам. Препарат обладает большой широтой терапевтического действия. Он изменяет иммунологическую реакцию на разных стадиях: стимулирует активность макрофагов, усиливает пролиферацию, цитотоксическую активность лимфоцитов, усиливает число и активность фагоцитоза. Известно, что изоприназин не оказывает влияние на функции нормальных полиморфноядерных лейкоцитов. 2.4. Производные имидазола К этой группе иммуностимуляторов относится левамизол, дибазол и кобальтсодержащие производные имидазола. Левамизол: это белый порошок, хорошо растворяется в воде, малотоксичен. Препарат является эффективным противоглистным средством. Влияние левамизола на иммунологические процессы было обнаружено позднее. Левамизол стимулирует в основном клеточный иммунитет. Он является первым препаратом, имитирующим гормнальную регуляцию иммунной системы, то есть модулирование регуляторных Т-клеток. Способность левамизола имитировать тимусный гормон обеспечивается его имидозолоподобным воздействием на уровень циклических нуклеотидов в лимфоцитах. Возможно, что препарат стимулирует тимопоэтинрецепторы. Препарат благоприятно влияет на иммунологический статус путем восстеновления эффекторных функций перефирических Т-лимфоцитов и фагоцитов, стимуляции созревания предшественников Т-лимфоцитов аналогично действию тимусных гормонов. Левамизол является мощным индуктором дифференцировки. Препарат вызывает быстрый эффект (через 2 часа при пероральном приеме). Повышение активности макрофагов с помощью левамизола играет большую роль в способности препарата повышать иммунологические свойства организма. Лечение левамизолом приводит к уряжению, укорочению и снижению интенсивности инфекционного процесса. Препарат понижает воспалительные явления при угрях, восстанавливает сниженную функцию Т-клеток. Имеются данные о значении левамизола при лечении онкологических заболеваний. Он удлиняет продолжительность ремиссии, увеличивает выживаемость и предупреждает метастазирование опухоли после ее удаления или лучевой и химиотерапии. Каким образом реализуются эти эффекты? Это зависит от повышения левамизолом активности клеточного иммунитета у онкологических больных, от усиления иммунного контроля в котором играют роль стимулируемые левамизолом Т- лимфоциты и макрофаги. Левамизол не повышает иммунной реакции выше нормального для человека уровня и особенно он эффективен у онкологических больных с иммунодефицитными состояниями. Побочные реакции левамизола: желудочно-кишечные расстройства в 90% случаев, возбуждение ЦНС, гриппоподобное состояние, аллергические кожные высыпания, головная боль, слабость. Дибазол: препарат, который обладает свойствами адаптогена - стимулирует гликолиз, синтез белка, нуклеиновых кислот. Применяется чаще с профилактической целью, а не с лечебной. Уменьшает восприимчивость к инфекциям, вызываемых стафилококком, стрептококком, пневмококком, сальмонеллами, риккетсиями, вирусами энцефалита. Дибазол при введении в организм в течение трех недель предупреждает заболевание ангиной, катаром верхних дыхательных путей. Дибазол стимулирует образование интерферона в клетках, следовательно, он эффективен при некоторых вирусных инфекциях. 2.5. Препараты разных групп. Тимозин. Основной эффект - индукция созревания Т-лимфоцитов. Данные о влиянии тимозина на гуморальный иммунитет противоречивы. Существует мнение, что усиливая проявление иммунных реакций, тимозин снижает образование аутоантител. Влияние тимозина на клеточные реакции иммунитета определило сферу его клинического применения: первичные иммунодефицитные состояния, опухоли, аутоиммунные нарушения, вирусные инфекции. Витамины. Витамины, являясь коферментами или их частью, благодаря своей роли, в обменных процессах оказывают весьма значительное влияние на функции различных органов и систем организма, в том числе и на системы иммунитета. Чрезвычайно широкое использование витаминов, часто в дозах, существенно превышающих физиологические, делает понятным интерес к их влиянию на иммунитет. а) витамин С. По многочисленным данным дефицит витамина С приводит к отчетливому нарушению Т-системы иммунитета, система же гуморального иммунитета более устойчива к С-витаминной недостаточности. Кроме величины дозы большое значение имеет характер сочетания витамина С другими препаратами, например, с витаминами группы В. Стимуляция фагоцитоза связана с непосредственным влиянием его на фагоциты и зависит от величины дозы препарата. Полагают, что витамин С увеличивает чувствительность бактерий к лизоциму. Однако, после длительной терапии большими дозами витамина С возможно развитие резкого гиповитаминоза витамина С после прекращения его приема. б) Тиамин (В1). При гиповитаминозе В1 наблюдается снижение иммуногенеза по отношению к корпускулюрным антигенам, снижение устойчивости к некоторым инфекциям. Влияние на фагоцитоз происходит путем вмешательства в углеводно-фосфорный обмен фагоцитов. в) Цианокобаломин (В12). Очевидно, эффективность витамина В12 в нормальных дозах при крайне расстроенных гемопоэтических и имунологических функциях (нарушение дифференцировки В-клеток, снижение числа плазмоцитов, антител, лейкопения, мегалобластная анемия, рецидивирующая инфекция). Но отмечается стимулирующее влияние витамина В12 на рост опухоли (в отличие от В1, В2, В6). Одним из основных иммуномоделирующих действий витамина В12 является влияние на обмен нуклеиновых кислот и белков. Недавно синтезирован коферментный препарат В12 - кобамамид, который нетоксичен и обладает анаболическими свойствами и в отличие от витамина В12 нормализует нарушенный липидный обмен у больных атеросклерозом. Общетонизирующие средства: препараты лимонника, элеутерококка, женьшеня, радиолы розовой. Ферментные препараты: лизоцим. Антибиотики: при антигеноспецифической ингибиции фагоцитоза. Змеиный яд: лечебные препараты, содержащие офидитоксин (випратоксин, випералгин, эпиларктин) увеличивают активность комплемента и лизоцима, увеличивают макрофагальный и нейтрофильный фагоцитоз. Микроэлементы.3. Принципы дифференцированной иммунокоррекции. Известно, что любое заболевание сопровождается развитием иммунодефицитных состояний (ИДС). Существуют методы оценки иммунного статуса, которые позволяют обнаружить пораженные звенья иммуносистемы. В большинстве случаев имеет место неспецифическая иммунокоррекция. Но нужно учитывать, что многие иммуномодуляторы вызывают и неиммунное действие. Можно подумать, что иммунокоррекция не имеет перспектив. Но это не так. Просто нужно подходить к этой проблеме с двух позиций: 1.- в организме существуют общие универсальные реакции, отражающие патологию. 2.- существуют тонкости патогенеза многих, например, бактериальных токсинов, которые вносят свой вклад в механизм иммунных расстройств. Из этого можно сделать вывод об актуальности дифференцированного назначения иммуномодуляторов. Существенным минусом в диагностике ИДС является отсутствие четкой градации, поэтому иммуномодуляторы часто назначаются без учета степени иммунных расстройств и активности препарата. Выделяют три степени ИДС: 1 степень - снижение количества Т-клеток на 1-33% 2 степень - снижение количества Т-клеток на 34-66% 3 степень - снижение количества Т-клеток на 67-100% Для определения ИДС применяют иммунологический графический анализ. Например, при пиелонефрите, ревматизме, хронической пневмонии выявляется третья степень ИДС; при хроническом бронхите - вторая; при язвенной болезни желудка и ДПК - первая. Мнение о том, что большинство традиционных лекарственных препаратов не оказывает на иммунную систему никакого действия, представляется ошибочным и устаревшим. Как правило, они либо стимулируют, либо подавляют иммунную реакцию. Иногда сочетание традиционных лекарственных средств с учетом их иммунотропности может устранить иммунологические расстройства у больных. Это очень важно, так как если у препарата есть иммуносупресорное свойство, что неблагоприятно; иммуностимулирующее свойство тоже неблагоприятно, так как оно может способствовать развитию аутоиммунных и аллергических состояний. При комбинации препаратов возможно усиление иммуносупрессорных и иммуностимулирующих эффектов. Например, сочетание антигистаминных и антибактериальных средств (пенициллин и супрастин) способствует развитию супрессорных качеств обоих препаратов. Очень важно знать основные мишени действия иммуномодуляторов, показания по их применению. Несмотря на определенность действия, тинозин, нуклеинат натрия, ЛПС, левамизол активируют все основные звенья иммунной системы, то есть их можно принимать при любых формах вторичных ИДС с дефицитами Т- и В-клеточных систем, фагоцитарной системы, их сочетаний. Но такие препараты как катерген, зиксорин имеют выраженную селективность действия. Избирательность действия иммуномодуляторов зависит от исходного состояния иммунного статуса. То есть эффект иммунокоррекции зависит не только от фармакологических свойств препарата, но и от исходного характера иммунных расстройств у больных. Перечисленные выше препараты эффективны при нарушении любого звена иммунитета, при условии их подавления. Длительность действия иммуномодуляторов зависит от их свойств, механизма действия, иммунологических показателей больного, характера патологического процесса. Благодаря экспериментальным исследованиям установлено, что повторные курсы модуляции не только не формируют процесса привыкания или передозировки, а усиливают выраженность эффекта действия. Иммунные расстройства редко затрагивают все звенья иммунной системы, чаще они бывают изолированными. Иммуномодуляторы влияют только на измененные системы. Установлена связь между иммуномодуляторами и генетической системой организма. В большинстве случаев максимальна эффективность иммуномодуляторов у больных со второй группой крови при дизентерии, при гнойных инфекциях мягких тканей - с третьей группой крови. Показаниями для применения моноиммунокорреги-рующей терапии служат: а) ИДС 1-2 степени; б) отягощенное затяжное клиническое течение заболевания; в) тяжелая сопутствующая патология: аллергические реакции, аутоиммунная реакция, истощение, ожирение, злокачественные новообразования. Пожилой возраст. г) атипичные температурные реакции. Сначала назначают малые иммуноекорректоры (метацин, витамин С), если эффекта нет, то используют более активные препараты. Комбинированная иммунокоррегирующая терапия - это последовательное или одновременное применение нескольких иммуномодуляторов с различным механизмом действия. Показания: 1- хроническое течение основного патологического процесса (более трех месяцев), частые рецидивы, сопутствующие осложнения, вторичные заболевания. 2- синдром интоксикации, нарушение обмена веществ, потеря белка (почками), глистная инвазия. 3- безуспешная иммунокоррегирующая терапия в течение одного месяца. 4- увеличение степени ИДС, комбинированное поражение Т- и В-звеньев, Т-, В- и макрофагального звена, разнонаправленные нарушения (стимуляция одних процессов и угнетение других). Необходимо осветить понятие о предварительной иммуннокоррекции. Предварительная иммунокоррекция - это предварительное устранение иммунной патологии для улучшения базовой терапии; используется для профилактических целей. Основные принципы применения иммуномодуляторов.  Эффект иммунотерапии зависит от основных антигенных различий опухолевых и нормальных клеток. Преимущество иммунотерапии заключается в возможности подавления пролиферации опухолевых клеток без подавления пролиферации нормальных. Иммунотерапия используется местно для борьбы с клинически не проявляющимися микроскопическими изменениями, характерными для опухолевого роста, как дополнение к операции. Иммунитет организма выше всего тогда, когда опухоль растет местно, и ухудшается при ее метастазировании. Иммунотерапия скорее должна дополнять, нежели конкурировать с доступными ныне методами борьбы со злокачественными опухолями. Рекомбинантные методы генной инженерии повысили возможность создания очищенных биологически активных веществ, являющихся модуляторами иммунного ответа, и способствовали использованию таких веществ, как ИЛ-2 и фактор некроза опухолей в качестве противоопухолевых препаратов. Активная специфическая иммунотерапия представляет собой попытку стимулировать иммунный ответ на антигены данной опухоли. При этом методе используются вакцины, созданные из опухолевых клеток или опухолевых антигенов. До вакцинации опухолевые клетки должны быть лишены способности к размножению. Это может быть достигнуто путем лучевой и тепловой обработки или путем замораживания. Чем выше активность вакцины, тем выше вероятный иммунный ответ и вероятность регрессии опухоли. По этой причине иммунологические адъюванты, такие как вакцина БЦЖ, Corynebacterium parvum и адъювант Фрейнда, используются с противоопухолевой вакциной', чтобы усилить иммунный ответ организма. Результаты этой стратегии сегодня, увы, не впечатляют. По мере расширения наших знаний о цитокинах, которые усиливают иммунный ответ, активная иммунотерапия может стать более эффективной. Пассивная иммунотерапия При пассивной иммунотерапии применяется системное введение специфической противоопухолевой сыворотки с целью подавления опухолевого роста. С клетками-эффекторами могут взаимодействовать антитела только определенных классов и подклассов. Примером пассивной иммунотерапии может служить использование мышиных моноклональных антител. Однако их применение у человека ограничивается их собственной антигенностью. Иммунотоксины. Иммунотоксины — туморспецифические антитела, сцепленные с токсичными молекулами. В качестве иммунологических носителей этих веществ предпочтительны моноклональные антитела. Опробован большой ряд токсичных молекул, включая радиоактивные изотопы, традиционные цитостатики, растительные и бактериальные токсины. До сих пор общий лечебный эффект от применения иммунотоксинов не изучен. Адаптивная иммунотерапия. При адаптивной иммунотерапии обладающие иммунными свойствами лимфоидные клетки вводят в организм реципиента, чтобы они разрушали опухоль. Эти иммунные лимфоидные клетки распознают опухоль и становятся классическими цитолитическими Т-лимфоцитами. Использование лимфокинами активированных киллеров (ЛАК) было впервые осуществлено Розенбергом (Rosenberg) и соавт. ЛАК — лимфоциты с цитотоксическими свойствами, генерированными в присутствии ИЛ-2. Биохимический механизм распознавания этими клетками опухолевых клеток не совсем ясен. Клинические испытания с использованием аутологичных ЛАК и повторного системного назначения ИЛ-2 сопровождались отчетливым объективным положительным эффектом у некоторых больных с массивными метастазами рака. Комбинированное применение ЛАК и ИЛ-2, однако, сопровождается значительным токсическим эффектом. (Отечественный препарат- “ронколейкин”, представляющий собой рекомбинантный дрожжевой ИЛ-2,не имеет таких побочных реакций. — Прим. ред.)При неспецифической иммунотерапии используют определенные вещества, обладающие способностью неспецифично усиливать резистентность организма против вирусов, грибков и бактерий. Эти вещества стимулируют иммунный ответ против широкого спектра антигенов, в том числе и опухолевых. Свежим примером неспецифической иммунотерапии является использование ослабленных бактерий бычьего туберкулеза (БЦЖ). Мортон (Mort on) и соавт. наблюдали регрессию 90% внутрикожных метастазов злокачественной меланомы после введения в них БЦЖ больным с сохраненным в целом иммунным ответом. Узлы, в которые не вводилась БЦЖ, также регрессировали у 20% больных.К другим веществам, которые неспецифично стимулируют иммунную систему, относятся С. parvum, бактериальные антитоксины и полинуклеотиды. Другой формой неспецифической иммунотерапии является использование веществ, способных восстановить угнетенный иммунитет. К таким веществам относятся гормоны вилочковой железы, такие как тимозин, и противоглистный препарат левамизол. Недавно было показано улучшение выживаемости после операции по Дьюку (Duke) больных с аденокарциномой С ободочной кишки при дополнительной терапии левамизолом и 5-фторурацилом.  ОПЫТ ПРИМЕНЕНИЯ ФИЗИО - РЕФЛЕКСОТЕРАПИИ В ДИАГНОСТИКЕ И КОРРЕКЦИИ ИММУНОДЕФИЦИТНЫХ СОСТОЯНИЙ .Леонид Воробьев ЛДЦ “Квантовая медицина”, Кременчуг, Украина .На практике врач чаще всего вспоминает об иммунитете в момент разговора об инфекционных, воспалительных заболеваниях и в меньшую меру при других болезнях. Наш профессиональный менталитет в основном направлен на выбор этио - патогенетического лечения заболевания и добившись, исчезновения клиники заболевания мы, как бы считаем, дело сделанным и расстаемся с пациентом. Однако с ним один на один остается его иммунитет и собственно он диктует, как скоро начнется обострение или реализуется новое заболевание. Ведущая роль в переходе патологии в хроническое, атипичное течение болезни, росте болезненности населения отводится иммунодефицитному состоянию (ИДС). По данным Московского центра “Иммунопрофилактика” (1986-1988годы) - ИДС диагностировалось у 40% взрослого и у 60% детского населения. В 1997 году (Луганск) состояние иммунодефицита диагностировалось у 80% населения обратившегося в поликлинику. По статистическим данным (Киев, 1999) практически всё население Украины находится в зоне иммунологического неблагополучия и 50% из них уже имеют клинические маркеры ИДС, остальные находятся в стадии лабораторного ИДС. В конечном счете, это и обусловливает до 4 и более патологий уже на одного ребенка. Проводя только лечение, какого либо заболевания и не восстанавливая иммунитет, мы имеем нестойкие результаты лечения, а в целом постепенное ухудшение здоровья населения. Восстановлением иммунитета необходимо заниматься врачу любой специальности. Поэтому иммунокоррекция не столько с лечебной целью, сколько с профилактической целью становится актуальной задачей для медицины в целом. Классические методы оценки состояния иммунитета трудоемки, дороги и не доступны всем слоям населения. Иммунокоррекция специфическими медикаментозными средствами – сложна, ответственна и может иметь побочные, непредсказуемые проявления, ухудшая состояние иммунной системы. Системный ответ иммунитета обеспечивается лимфоцитами и на 70% зависит от Т- клеточного звена. В вилочковой железе тимоциты созревают и формируются в Т-лимфоциты. Для экспресс- диагностики вторичных тимусзависимых ИДС нами использовался метод тепловизионного анализа зон связанных с иммунокомпетентными органами, предложенный Нижегородской государственной медицинской Академией. Диагностику ИДС проводят в зонах расположения акупунктурных точек ( J20,21,22 Rp2,3,4) с использованием современной медицинской техники регистрирующей инфракрасное излучение человеческого тела. Данные регистраторы доступны любому учреждению и позволяют проводить скрининг состояния иммунитета у всего населения. Время тепловизионной диагностики ИДС занимает до 3-4 минут на одного человека. Уровень достоверности и чувствительности метода достаточно высок и совпадает с классическим подходом в 84-90%. Дополнительно мы использовали показатель уровня лимфоцитов в периферической крови. Диагностическим критерием ИДС считали - уровень лимфоцитов менее 1700 клеток в 1 мл. Тепловизионная диагностика вторичных, тимусзависимых ИДС -наиболее удачна для динамического наблюдения иммунитета у детей.Наш опыт термографической оценки состояния иммунитета в сочетании с уровнем лимфоцитов у детей и взрослых свидетельствует о наличии ИДС в среднем у 73-78% обследованных. Для амбулаторной практики, обеспечивающей должный эффект и безопасность иммунокоррекции, наиболее подходит иммунокоррекция экстраиммунного типа, которая может применяться врачами всех специальностей. Учитывая, что подавляющее число ИДС связано с нарушением клеточного метаболизма мы использовали набор методов обеспечивающих – детоксикацию организма, нормализацию клеточного метаболизма, иммунокорригирующие компоненты и физио - рефлексотерапию ИДС. Практический опыт показывает, что детоксикация организма, нормализация клеточного метаболизма приводит к нормализации работы иммунной системы и устранению вторичного ИДС. Применение же неспецифической стимуляции (адаптогены, физиотерапия) ускоряет наступление нормализации функций иммунной системы и увеличивает сроки нормального состояния иммунитета. Иммунокорригирующее рефлексотерапевтическое воздействие проводили различными физическими факторами со стимулирующими параметрами на акупунктурные точки связанные с иммунокомпетентными органами. При этом мы отметили разный по выраженности и направленности ответ на разные физические факторы. Контроль проводили по показателям: лейкоциты-лимфоциты в периферической крови. Анализ брали натощак с последующим рефлексотерапевтическим воздействием и контролем через два часа. Лимфоцитопения может быть как следствием снижения общего количества лейкоцитов без изменения формулы крови, так и с нормальным количеством лейкоцитов, но с уменьшенным числом лимфоцитов в формуле крови. Однако на практике довольно часто встречается значительное повышение количества лимфоцитов в формуле крови как при нормальных так и при сниженных показателях лейкоцитов, что также может быть отнесено к проблемам ИДС т.к. эти случаи сопровождаются клиническими маркерами ИДС. Эти особенности диктуют тактику дифференцированного подхода в выборе средств воздействия, чтобы в одних случаях увеличить количество лейкоцитов, не изменяя формулу крови, в других преимущественно повысить уровень лимфоцитов за счет изменения в формуле крови.
Поэтому целесобразно при недостаточном количестве лейкоцитов с нормальным или повышенным показателем лимфоцитов в формуле крови использовать методы с преимущественным увеличением лейкоцитов. При пониженном показателе лимфоцитов в формуле крови целесообразно стимулировать работу - вилочковой железы. Динамика результатов представлена в таблице.
Самые непрогнозируемые, даже противоположные ответные реакции иммунитета нами получены при использовании электростимуляциии в связи с чем мы отказались использовать её для проведения иммунокоррекции. В ситуации, когда необходимо увеличить число лимфоцитов (существенно не меняя количество лейкоцитов), целесообразно использовать такие физические методы воздействия как - КВЧ-терапия, УЗТ. В ситуации, когда необходимо увеличить число лимфоцитов в крови (не меняя состав формулы крови и в основном за счет общего увеличения лейкоцитов) целесообразно применять такие физические методы воздействия как – ИКЛ – лазер, магнитотерапия. В ситуации, когда необходимо увеличить как количество лимфоцитов в формуле крови, так и общее количество лейкоцитов целесообразно применять такие физические методы воздействия как – Red – лазер, дарсонвализация.Наиболее яркий ответ на физио- рефлексотерапевтическое воздействие, как со стороны лейкоцитов так и лимфоцитов отмечен при воздействии дарсонвализацией. Наиболее мягкий ответ отмечен при воздействии КВЧ терапии. Данные ответной реакции на физио- рефлексотерапевтическое воздействие могут оказаться полезными для выбора метода и тактики иммунокоррекции при разных, по выраженности- вторичных ИДС и получения индивидуального оперативного ответа необходимой силы. Для максимального эффекта при ликвидации ИДС необходимо сочетание рефлексотерапевтического воздействия с нормализацией клеточного метаболизма. При выраженном - ИДС мы проводили сначала метаболическую коррекцию и затем подключали рефлекторное воздействие. В целом иммунокоррекция экстраиммунного типа (метаболический и рефлексотерапевтический варианты) занимает 3-4 недели. В результате – у всего контингента пациентов были достигнута нормализация показателей уровня лимфоцитов и термопрофиля зон связанных с иммунокомпетентными органами. Повторная обращаемость за медицинской помощью у лиц прошедших иммунокоррекцию снизилась у детей в 2,8 раза, у взрослых в 1,8 раза. Применение данной иммунокорригирующей технологии подготавливает иммунную систему организма к её оптимальному функционированию, не вмешиваясь в отдельные звенья иммунитета и не нарушая её саморегуляторные механизмы, что обеспечивает данной технологии полную безопасность. В данном подходе к устранению ИДС термин - “иммунокоррекция экстраиммунного типа”, с научной точки зрения, может быть взят в кавычки так как проводимые мероприятия не обладают собственно иммуномодулирующими свойствами, но их применение приводит к нормазизации иммуного статуса. При комбинированном иммунокорригирующем воздействии уровень нормальных показателей держится до полугода и более, что в целом удовлетворяет потребностям профилактического направления медицины по поддержанию нормального состояния иммунитета. Для этого достаточно 2 раза в год (осенью и ранней весной) провести иммунокоррекцию экстраиммунного типа. Выводы: При нормальных тепловизионных показателях и сниженного показателя количества лимфоцитов в периферической крови целесообразно проводить только метаболический вариант иммунокоррекции. При наличии тепловизионных показателей свидетельствующих об ИДС целесообразно использовать сочетание физиотерапевтического и метаболического вариантов иммунокорркции. Случаи увеличенного количества лимфоцитов в периферической крови при наличии тепловизионных признаков ИДС, клинических маркеров ИДС – рассматриваются как один из вариантов ИДС. В случаях ИДС с измененным количеством лимфоцитов целесообразно применять физиотерапевтический вариант с дифференцированным подходом выбора физического фактора воздействия на органы иммунитета. У казанный тип иммунокоррекции используется в практической медицине около 15 лет, и громадный фактический материал убеждает в необходимости и в действенности иммунокорреции экстраиммунного типа, в том числе и с профилактической целью у широких групп населения, включая и детей. отдельных показателей лейкограммы Картину белой крови при различных. заболеваниях определяет совокупность следующих признаков: 1) общее количество лейкоцитов в 1 мм3 крови; 2) наличие ядерного сдвига нейтрофилов; 3) процентное соотношение отдельных видов лейкоцитов; 4) наличие или отсутствие дегенеративных изменений в клетках. Изменение общего количества лейкоцитов. Изменение числа лейкоцитов наблюдается в виде гиперлейкоцитоза или лейкопении. Гиперлейкоцитоз встречается при некоторых острых инфекциях, воспалительных и гнойно-септических процессах, коматозных состояниях (в частности, при уремической, диабетической и печеночной комах), различных интоксикациях (пищевой, мышьяковистым водородом, хинином, угарным газом, нитробензолом), при злокачественных новообразованиях, инфаркте миокарда, после обильных кровопотерь, при гемолитических кризах, сотрясении мозга, оперативных вмешательствах, эпилепсии и т. п В своей основе лейкоцитоз зависит от реактивного состояния костного мозга и его лейкопоэтической деятельности. В связи с этим понятно, почему у ослабленных лиц с плохой общей сопротивляемостью организма, невзирая, на наличие воспалительного или гнойно-септического процесса, лейкоцитоз может отсутствовать. Каждому врачу из практики известно немало случаев крупозной пневмонии, острого аппендицита и других заболеваний, протекающих не только без лейкоцитоза, но нередко сопровождающихся даже лейкопенией. Вместе с тем следует помнить, что состояние лейкопоэтической деятельности определяется не только реактивностью самого кроветворного органа, но и раздражителем — его характером и силой. “Поэтому не приходится удивляться тому, что при наличии. гнойного процесса, при котором гной свободно выделяется наружу, имеется нормальный лейкоцитарный состав крови или лейкопения с некоторым ядерным сдвигом нейтрофилов. Такой] состав крови не будет показателем “достаточности или недостаточности” реакции кроветворного аппарата по отношению к инфекции, как не будет и показателем “благоприятного или неблагоприятного характера заболевания”. Большое количество лейкоцитов наблюдается при заболеваниях системы крови—лимфогранулематозе, эритремии и.особенно при лейкозах и лейкемоидных состояниях. Увеличение количества лейкоцитов может также возникать при введении некоторых лекарственных средств (камфора, адреналин, инсулин), при различных физиологических состояниях, например при беременности (с 5- 6-го месяца), в периоде лактации; в предменструалыюм периоде, после физических и психических инапряжений, особенно у легко возбудимых лиц, Лейкопения наблюдается, довольно закономерно при некоторых инфекциях (брюшной тиф, малярия,бруцеллез, затяжной септический эндокардит, вирусный грипп, корь, болезнь Боткина и др.) и коллагенозах, в частности при системной красной волчанке, синдроме Фелти, иногда—при рецидивирующем ревмокардите. При воспалительных и гнойно-септических заболеваниях смена лейкоцитоза лейкопенией служит показателем угнетения кроветворения, что в свою очередь является критерием пониженной реактивности организма. Подобное течение воспалительно -гнойного заболевания без лейкоцитоза наблюдается у стариков и истощенных лиц. Лейкопенией сопровождаются также различные заболевания системы крови: острый лейкоз (почти в половине случаев), пернициозная анемия, некоторые спленопатии, протекающие с гиперспленизмом, и, наконец, гипопластические состояния кроветворения, наблюдаемые при. хронической интоксикации бензолом, алиментарно-токсической алейкии, лучевой болезни, лекарственных воздействиях (пирамидон, сульфаниламиды, барбитураты, производные тиоурацнла, различные цитостатические препараты и др.).Особый интерес представляют лейкопении, .возникающие в результате повышенного выведения лейкоцитов из организма. Как полагает Д. Н. Яновский; при некоторых воспалительных заболеваниях в силу анатомических особенностей строения органа создаются условия для свободного оттока продуктов воспаления .и, повышенного выведения из организма лейкоцитов. Это влечет, за собой потерю белка, нуклеиновых кислот, необходимых для построения гранулоцитов, в результате чего понижается резервная возможность лейкопоэтической функции костного мозга и устанавливается новое равновесие на более низком уровне общего количества лейкоцитов. К числу таких заболеваний можно отнести гастрит, колит, хрлецисто- ангиохолит, эндометрит и некоторые другие.Наконец, среди лейкопенических состояний выделяют группу лейкопений, развивающихся при эндокринных заболеваниях (акромегалии, аддисоновой болезни, иногда—тиреотоксикозе и в особенности при различных функциональных заболеваниях центральной нервной системы. Так, М И Ульянов у 100 больных с функциональными расстройствами центральной нервной системы типа невроза выявил лейкопению с абсолютной нейтропенией. Наклонность больных неврозом к лейкопении подтверждают и другие авторы. Повидимому, в этих случаях идет речь о чисто перераспределительном характере лейкопении.Таким образом, лейкопения у части “практически здоровых ” лиц может быть либо следствием хронических воспалительных процессов, главным образом органов брюшной полости, либо результатом функционального нарушения регуляция кроветворения.Учитывая, с одной стороны, столь многообразные причины лейкопении, а с другой — различный механизм их возникновения, мы рекомендуем пользоваться патогенетической группировкой лейкопенических состояний с учетом различных этиологических факторов. Согласно патогенетическому принципу; все известные лейкопении подразделяются на четыре основные группы. 1. Лейкопении вследствие нарушения костномозговой деятельности — миелотоксические.2. Лейкопении, обусловленные наличием в крови аутоантител и развитием процессов лейкоагглютинации и лейколиза,-аутоиммунные Примером являются иммуноаллергические формы агранулоцитоза, а также иммунолейкопении, наблюдаемые при системной красной волчанке и нередко при рецидивирующих формах ревмокардита (по нашим данным, примерно у 1/5 больных). 3. Лейкопении перераспределительные, не сопровождающиеся изменением лейкограммы и нарушением лейкопоэза в костном мозге. 4. Лейкопении, связанные с усиленным выведением из организма лейкоцитов — “выделительные”. Патогенетическая классификация значительно расширяет наши представления о лейкопенических состояниях, а в ряде случаев дает возможность для выбора рациональной терапии. Ядерный сдвиг нейтрофилов. Появление в гемограмме молодых и дегенеративных форм нейтрофилов является характерным признаком, свойственным инфекционным и воспалительным процессам, злокачественным новообразованиям, различного рода интоксикациям, Различают следующие виды ядерного сдвига: регенеративный, дегенеративный и лейкемоидный. При регенеративном сдвиге увеличивается содержание палочкоядерных и юных нейтрофилов, при дегенеративном—только палочкоядерных нейтрофилов наряду с дегенеративными изменениями в клетках. Лейкемоидный сдвиг характеризуется появлением более незрелых форм ( миелоцитов, промиелоцитов, а иногда и миелобластов), симулируя подчас картину крови при лейкозах.Регенеративный сдвиг обычно протекает при увеличенном количестве лейкоцитов и является показателем повышенной деятельности костного мозга. Он наблюдается главным образом при воспалительных и гнойно-септических процессах Дегенеративный сдвиг - показатель функционального угнетения костного мозга и его лейкопоэтической деятельности. Обычно он сопровождается лейкопенией и встречается при инфекциях, протекающих под видом нейтропенической фазы угнетения. Исключение составляют различные интоксикации (при сальмонеллезах, токсической дизентерии, остром перитоните, уремической и диабетической коме), сопровождающиеся наряду с выраженным дегенеративным сдвигом нарастанием общего числа лейкоцитов. Лейкемоидные сдвиги являются обычно отражением своеобразной реактивности больного организма (см. раздел “Лейкемоидные реакции”). В клинике основное значение имеет степень ядерного сдвига, нейтрофилов (так называемый ядерный индекс сдвига) как важнейший критерий тяжести заболевания. Ядерный индекс сдвига определяется формулой М + Ю + П С и в норме равен 0,05—0,08. Из клинических наблюдений вытекает, "что тяжелые инфекции и гнойно-септические заболевания протекают с высоким индексом сдвига (от единицы и выше); заболевания умеренной тяжести характеризуются индексом сдвига от 0,3 до единицы; при легкой степени заболевания индекс сдвига не превышает 0,3. В некоторых случаях отмечается ядерный сдвиг нейтрофилов вправо с индексом сдвига 0,04 и меньше. В этих случаях среди нейтрофилов обычно преобладают зрелые формы с пятыо -шестыо сегментами вместо обычных трех. Сдвиг вправо встречается при аддисон-бирмеровской анемии, полицитемии, лучевой болезни, а также у 20% здоровых лиц (Н Н Бобров). При инфекционных и воспалительных заболеваниях появление сдвига вправо указывает обычно на благоприятное течение заболевания, так как после выздоровления сдвиг исчезает и лейкограмма нормализуется. Оценка ядерного сдвига нейтрофилов вызывает затруднение в случан наличия пельгеровской аномалии ядер, связанной с преждевременной кон- цией ядерного хроматина и параллельным нарушением их. способности к сегментации. Иначе говоря, в этом случае форма ядра отстает от; его структурного развития. Вследствие этого ядра пельгеровских нейтрофилов принимают форму эллипса, боба, земляного ореха (арахиса), что дает право неопытным лаборантам для ошибочной илентифиции этих клеток с миелоцитами, метамиелоцитами и палочкоядерными нейтрофилами. На самом же деле ядра их имеют грубо-глыбчатую, пикнотическую структуру и обычную для зрелых нейтрофилов цитоплазму, содержащую мелкую зернистость. В функциональном отношении пельгеровские нейтрофилы не отличаются от нормальных зрелых нейтрофилов.В настоящее время бесспорно доказан семейно-наследственный характер пельгеровской аномалии, передающейся по доминантному типу. Изменение процентного соотношения отдельных видов: лейкоцитов. Эозинофилия по современным представлениям является своеобразной реакцией организма на поступление в него чужеродного белка и гистамина. Она связана с антигистаминной, антитоксической и фагоцитарной функциями эозинофилов. С этой точки зрения эозинофилы играют особую роль в течении аллергических реакций.Эозинофилия наблюдается в следующих случаях: 1.. При паразитарных заболеваниях (трихинеллезе, описторхозе, аскаридозе, эхинококке, лямблиозе и др.). При наличии живых паразитов в тканях организма (например, при эхинококке) эозинофилия выражена более отчетливо, чем при кишечным инвазиях. 2. При различных аллергозах (бронхиальной астме, перепончатом колите, эозинофильных инфильтратах органов, дерматозах и пр.). 3. При коллагенозах (ревматизме, узелковом периартериите, дерматомиозите). 4. При лечении некоторыми медикаментозными средствами (антибиотики, сульфаниламидные и печеночные препараты, АКТГ и др.) лекарственная гиперэозинофилия. 5. При заболеваниях, системы крови (лимфогранулематозе, хроническом миелолейкозе). 6. При злокачественных новообразованиях. 7. При ожоговой болезни , отморожениях.8. При некоторых эндокринопатиях (церебрально-гйпофи-зарной кахексии, микседеме). 9. При инфекционных заболеваниях, таких, как скарлатина, туберкулез и сифилис. 10. В клинической практике встречаются семейно -конституциональные и идиопатические эозинофилии, причина которых до сих пор не выяснена. Качественную оценку эозинофилии в течении всякого патологического процесса следует давать только при учете остальных компонентов гемограммы. Увеличение числа эозинофилов и отсутствие ядерного сдвига — показатель неинфекционной природы эозинофилии. При заболеваниях. протекающих с нейтрофильно-эозинопенической реакцией (воспалительные и гнойно-септические процессы), появление эозинофилов на фоне лимфоцитоза и незначительного ядерного сдвига нейтрофйлов является предвестником выздоровления. Сочетание гиперэозинофилии с лимфопенией и значительным ядерным сдвигом нейтрофилов наблюдается при инфекционно-аллергических заболеваниях (скарлатина, туберкулез, коллагенозы и др.). Индивидуальная оценка эозинофилии возможна лишь при правильном . учете основного заболевания. Эозинопения и анэозинофилия наблюдаются, почти как правило, при брюшном тифе, на высоте некоторых острых инфекций, в агональном состоянии. Прогностическое значение они имеют лищь в комплексе с другими компонентами гемограммы (с общим числом лейкоцитов и степенью ядерного сдвига). Клиническое толкование лимфоцитоза зависит от того, по какому гематологическому типу протекает данное заболевание. При заболеваниях нейтрофильно -эозинопенической группы появление лимфоцитоза указывает на фазу выздоровления (постинфекционный .лимфоцитов). При хронических инфекциях (туберкулез, сифилис) лимфоцитоз также является благоприятным признаком. Относительный лимфоцитоз при нейтропенических инфекциях (брюшном тифе, вирусном гриппе, кори и др.) характеризует гладкое течение инфекции и указывает на отсутствие в данный момент осложнений (менингита, пневмонии, перитонита и др.), при появлении которых лимфоцитоз сменяется лимфопенией. Лимфоцитоз при агранулоцитозе или лимфатической лейкемоидной реакции является неблагоприятным признаком, свидетельствующим о снижении микрофагоцитарной функции организма вследствие истощения гранулопоэза. Однако в указанных случаях необходимо разграничивать относительный лимфоцитоз от абсолютного, особенно при отклонениях от нормы общего количества лейкоцитов. Так, например, 60°/о лимфоцитов при общем количестве лейкоцитов 2000 составляет 1200 в 1 мм3, а те же 60% при 12000 лейкоцитов равны 7200. Если в первом случае картина крови характерна для агранулоцитоза, то во втором — абсолютный лимфоцитоз свидетельствует о гиперплазии лимфаденоидной ткани, что наблюдается, например, при лимфатической лейкемоидной реакции или хроническом лимфолейкозе. Лимфоцитоз встречается также при некоторых эндокринопатиях (тиреотоксикоз, микседеме, аддисоновой: болезни, дисфункции яичников), бронхиальной астме и неврастении; во время менструаций; при длительном применении фтивазида, при одностороннем углеводном питании. Лимфопения наблюдается при воспалительных и гнойно –септических заболеваниях, некоторых тяжелых инфекциях, лимфогранулематозе и в прогностическом отношении является неблагоприятным симптомом. Резко выраженная лимфопения в сочетании с абсолютной нейтропенией развивается при воздействии на организм ионизирующей радиации (лучевая болезнь). Моноцитоз отмечается при острых инфекционных, ааболеваниях: ветряной оспе, краснухе, кори, гриппе, дифтерии, осложненных формах скарлатины, сыпном тифе и особенно инфекционном мононуклеозе, При котором количество моноцитов (так называемых монопуклеаров) иногда может доходить до .50% При хронических инфекциях, таких как малярия, бруцеллез, висцеральный лейшманиоз и туберкулез, моноцитоз держится продолжительное время (иногда в течение нескольких месяцев) как показатель активной реакции ретикуло-гистопитарной системы. При этом моноцитоз, связанный с туберкулезным процессом, часто сочетается с выраженным формированием эпителиоидных бугорков во внутренних органах (гематогенно-диг семинированные формы туберкулеза). Появление его соответствует фазе гематогенной диссеминации. Когда туберкулезный процесс затихает, моноцитоз исчезает и вновь появляется при новой волне обсеменения. Однако в этих случаях следует иметь в виду. возможность появления моноцитоза при .наличии повышенной чувствительности к ПАСКу.. Количество моноцитов может быть увеличено_при злокачественных опухолях, лимфогранулематозе, .гепато-лиенальном синдроме Банти, кандидомикозе, эндокардитах, особенно при затяжном септическом эндокардите. В последнем случае моноциты двоякого генеза: костномозгового (за счет повышенной реакции ретикулогистоцитарной системы) и тканевого, вследствие эндотелиоза со свойственной ему повышенной десквамацией капиллярного эндотелия (так называемый гистио-моноцитоз).Моноцитопения наблюдается при тяжелых септических про-Я цессах, брюшном тифе ,и других инфекционных заболеваниях. Базофилия . Относительно роли базофилов в патологии до сих пор известно еще чрезвычайно мало. Данные литературы свидетельствуют о том, что это функционально активные клетки, депонирующие важнейшие медиаторы тканевого обмена (гепарин, гистамин и др..) и принимающие участие в аллергических и анафилактических реакциях, а также в процессе свертывания крови (Т. Р. Петрова). Увеличение их количества свыше 1% встречается главным образом при хроническом миелолейкозе, полицитемии, острых иммунотромбоцктопениях, а иногда при гипофункции щитовидной железы. Особенно важное диагностические значение приобретает базофилия при хроническом миелолейкозе (эозинофилыю-базофильная ассоциация), когда количество базофилов может достигать 5—7% и выше.Дегенеративные изменения лейкоцитов. Термин “дегенеративные изменения лейкоцитов”-сборное понятие, объединяющее целый ряд разнообразных изменений клеток: токсическую зернистость нейтрофилов, вакуолизацию цитоплазмы, наличие в лейкоцитах различных включений, дегенеративные изменения в ядре (пикноз и кариолизис ), повышенный лейколиз и т. п.Каково клиническое.значение дегенеративных изменений в клетках? Во-первых, эти изменения (особенно токсическая зернистость) являются весьма чувствительным показателем наличия в организме патологического процесса. Они нередко возникают при отсутствии ядерного сдвига и зачастую сохраняются продолжительное .время после клинического выздоровления. Во-вторых, патологическая зернистость представляет ценный дифференциально-диагностический признак при проведении дифференциальной диагностики ряда заболеваний, для которых нехарактерна зернистость заболеваний (малярия, брюшной тиф и др.), от сепсиса, протекающего с патологической зернистостью лейкоцитов; туберкулеза легких, обычно не дающего выраженной токсической зернистости от воспалительно-гнойных заболеваний легких, при которых она отчетливо выражена; раковой опухоли от воспалительного процесса. Особенно велико значение этой зернистости в случае “острого живота”, например при гангренозном аппендиците, протекающем иногда с небольшой температурой и нередко без лейкоцитоза. Наличие токсической зернистости является ранним признаком лучевой болезни и дифференциально-диагностическим критерием между лейкемоидными реакциями и лейкозом, обычно не сопровождающимся патологической зернистостью. Природа патологической зернистости до сих пор не установлена. Большинство авторов связывают ее с изменением.. коллоидно-химической структуры белков цитоплазмы. Однако, как указывает Н. А. Шмелев, этой концепции противоречит тот факт, что у больных с остро развивающейся интоксикацией патологической зернистости в нейтрофилах не наблюдается. Так, при остром перитоните, даже с летальным, исходом, в. крови .может не быть нейтрофилов с патологической зернистостью, хотя при этом заболевании имеется огромная площадь для всасывания токсинов и соприкосновения их с циркулирующими нейтрофилами. При крупозной пневмонии, сопровождающейся обычно наиболее резкими изменениями зернистости в нейтрофилах, эти изменения проявляются только к моменту кризиза, а не в первые дни болезни, когда интоксикация наиболее выражена. По видимому, патологическая зернистость имеет иной патогез чем ядерный сдвиг. Если последний возникает в начале развития инфекционно-воспалительного процесса, то появление патологической зернистости обычно указывает на значительную давность воспалительных явлений. Ведь не случайно параллелизм между ядерным сдвигом нейтрофилов и патологической зернистостыо выявлен лишь в 50% случаев Следовательно, определение аптологической зернистости не дублирует, а дополняет показатели ядерного сдвига в оценке динамики патологической процесса.Своеобразной формой дегенеративных изменений в клетках является феномен красной волчанки, сущность которого сводится к токсической дегенерации ядерного вещества и последующему высвобождению его из клеток в виде отдельных шаровидных образований Последние фагоцитируются неповрежденными лейкоцитами, так называемыми “волчаночными клетками”. Это обычные гранулоциты (реже монопуклеары), содержащие в цитоплазме аморфное гомогенное включение, окрашенное в пурпурный цвет и оттесняющее ядро к периферии клетки.Указанные образования нередко обнаруживаются в свободном виде или в окружении розеткообразных скоплений лейкоцитов. Подобное сочетание “телец красной волчанки”, розеткообразных скоплений лейкоцитов вокруг них и типичных “волчаночных клеток” составляет характерную “триаду Хазерика” Однако наибольшую ценность в диагностике диссеминированной. красной волчанки представляют “волчаночные клетки”, частота обнаружения которых колеблется, по данным разных авторов от 50 до 100°/о, значительно возрастая при повторных исследованиях крови. К сожалению, “волчаночные клетки” могут отсутствовать не только в ранних стадиях заболевания, но и в периоде ремиссии, а также после применения кортикостероидныя гормонов. Леикемоидные реакции . В эту группу входят реактивные изменения крови, возникающие при весьма разнообразных заболеваниях и характеризующиеся появлением в периферической крови незрелых элементов Уже сам термин “лейкемоидная” реакция до некоторой степени указывает на смысловое значение этих состояний. Первая часть его (“лейкем”) отражает общие с лейкозом гематологические признаки, а вторая часть (“ондные”) говорит лишь о внешнем сходстве с лейкозами.Лейкемоидные сдвиги являются отражением своеобразной реакции организма при самых различных заболеваниях. Лишь в исключительных случаях развитие их связано со спецификой возбудителя (инфекционный мононуклеоз, малосимптомный инфекционный лимфоцитоз). Существуют два типа лейкемоидных реакций: миелоидный и лимфатический. Лейкемоидные реакции миелоидного типа наблюдаются в следующих случаях: 1) при различных инфекциях (сепсис, гнойные процессы, туберкулез, дизентерия и т д ); 2) при ионизирующей радиации, 3) при шоковых состояниях, 4) при экзогенных и эндогенных интоксикациях (сульфаниламиды, бигумаль, угарый газ, уремическая и печеночная кома); 5) при гемолитических кризах и острых кровопотерях; 6) при метастазах рака в костный мозг. По картине крови миелоидые реакции чаще всего напоминают хронический миелолеикоз. Значительно реже наблюдаются Лейкемоидные реакции миелобластического типа, симулирующие клинику острого лейкоза. Основными критериями дифференциальной диагностики миелоидных реакций с миелолейкозами являются: наличие в большинстве случаев связи с основным заболеванием, обусловившим реакцию; отсутствие, за редким исключением, резкого ядерного сдвига (до “бластных” форм) как в лейкограмме, так и в миелограмме, а также отсутствие “лейкемического зияния”, свойственного острому лейкозу, и эозинофильно-базофильной ассоциации, патогномоничной для хронического миелолейкоза, как правило, незначительная степень анемии, в то время как при остром лейкозе она резко выражена (исключение составляют миелокарцинозы, часто проявляющиеся миелоидной реакцией в сочетании с выраженной анемией); наличие ,токсической зернистости лейкоцитов и, наконец, обратимость реакции при устранении вызвавшей ее причины Лейкемоидная реакция лимфатического типа наблюдается при детских инфекциях (краснуха, коклюш, ветряная оспа), туберкулезе, инфекционном мононуклеозе и малосимптомном инфекционном лимфоцитозе. Малосимптомный инфекционный лимфоцитов представляет собой по-видимому, вирусное заболевание (хотя этиология его окончательно еще не установлена), в основе которого лежит гиперплазия лимфоидной и отчасти реш-кулогистоцитарной ткани. Заболевание встречается преимущественно в детском возрасте (до 10 лет) и характеризуется выраженной контагиозностью.  Б.Б.Першин, С.Н.Кузьмин, В.В.Чиркин, В.Я.Медведев, М.А.Нархова, К.И.Эль-Рабаа Центр "Иммунопрофилактика", Москва, Россия Важнейшее направление современной иммунологии - клиническая иммунология, включает в себя иммунодиагностику, иммунопрофилактику, иммунокоррекцию и иммунореа-билитацию, которые достаточно успешно осуществляются в массовых и индивидуальных исследованиях. Массовые обследования, проводимые у нас в стране и за рубежом, стали базисом для новой ветви иммунологии - экологической иммунологии. Прогресс в клинической иммунологии в известной мере связан с разработками, направленными на стандартизацию диагностических систем, доступных практическим лабораториям, равно как и математико-статистическими приемами, призванными интегрировать все разрастающийся массив информации. Выявление иммунокомпрометированных лиц, в свою очередь, ставит задачи для решения проблем иммунореабилитации и иммунорпрофилактики, которые нуждаются в научно обоснованных дозировках и рациональных схемах введения иммунофармако-логнческих препаратов. Все это требует проведения контролируемых испытаний по количественной оценке эффективности имму-номодулирующих препаратов и их комбинаций. В настоящей работе сделана попытка подведения некоторых итогов многолетней работы Центра "Иммунопроилактика" РАМН в данном направлении. В банке данных Центра проходят обработку результаты массовых и индивидуальных исследований среди 200 тыс. рабочих и служащих промышленных предприятий России, в том числе проводится анализ иммунологических реакции 20 тыс. обследованных индивидуумов. Сегодня в современной иммунологии можно поставить более 1000 различных диагностических тестов для изучения иммуноло-гической реактивности человека. С одной стороны - это достижение, с другой - встает обоснованный вопрос об информативности используемых иммунологических реакций. Были предложены оригинальные статистические интеграционные методы обработки. Однако сложности интеграции и особенно интерпретации иммунологической информации остаются одной из актуальнейших проблем клинической иммунологии. Для массовой диагностики вторичных иммунодефицитов в практических лабораториях необходим научно обоснованный отбор тестов, отвечающих следующим требованиям: информативности по корреляционной связи с заболеваемостью, стандартизованности, воспроизводимости, достаточной пропускной способности, простоте выполнения, использования капиллярной крови и др. При оценке иммунологической реактивности важную информацию можно получать в результате исследований системы местного иммунитета . В конце 70-х годов был предложен метод оценки иммунологической реактивности с использованием реакций местного и гуморального иммунитета по результатам количественной оценки иммуноглобулиновых уровней и анамнестических антител, иммунологических реакций, поддающихся строгой стандартизации, в том числе и в экзокринных секретах. При разработке метода были использованы результаты обследований спортсменов-профессионалов, членов сборных команд по разным видам спорта. В сравнительных исследованиях проведен отбор доступных тест-систем, используемых в клинической иммунологии. При отборе иммунологических реакций решающее значение имели результаты, полученные у спортсменов, что подтвердило концепцию антропомаксимологии [8]. Одним из положений концепции являлся тезис о том, что результаты исследований в спорте высших достижений могут быть с успехом адаптированы для людей, не занимающихся спортом. Самый высокий уровень корреляционной связи был зафиксирован с иммуноглобулиновыми уровнями сыворотки крови (г=0,85-0,996), слюны (г—0,769-0,977) и с титрами нормальных антител (г-0,751-0,938 и г=0,801-0,929, соответственно). Исключение составили лишь сывороточные IgG, коэффициент корреляции которых с заболеваемостью составил всего лишь 0,50. Известно, что попытки подобного корреляционного анализа предпринимались неоднократно в разных профессиональных группах обследуемых без ярко выраженного эффект”. Только среди спортсменов экстракласса удалось определить параметры до нозологической иммунодиагностики, позволяющие четко прогнозировать заболеваемость и тем самым корректировать физические нагрузки на разных этапах подготовки, включая ответственные соревнования. Кроме того, только у спортсменов был описан феномен полного исчезновения отдельных классов иммуноглобулинов из сыворотки крови и экзокринных секретов в моменты предельных физических и синхоэмоциональных нагрузок, присущих современному профессиональному спорту. Диагностические приемы выявления вторичных иммунодефицитных состояний, полученные на модели спорта, были адаптированы для рабочих и служащих промышленных предприятий. В дальнейшем соавторстве с рядом нммунологических лабораторий были определены нормативные показатели целого ряда иммунологических реакций. Анализ результатов обследования, полученный у 20 000 человек разных профессиональных групп, свидетельствует о том, что вторичные иммунодефициты встречаются у 30% людей, занятых промышленным производством, у 40% профессиональных спортсменов и более чем у 60% обследованных детей. Следует подчеркнуть, что на производствах, где имелись значительные превышения ПДК производственных вредностей, частота развития иммунодефицитов также превышала отметку 60%. Эти данные легли в основу принципов формирования групп иммунологического риска, среди которых проводится работа по иммунопрофилактике и иммунореабилитации. Причины развития иммунологической недостаточности многообразны и зависят от большого количества факторов. Среди них, в первую очередь, следует отметить антропогенное воздействие на окружающую среду обитания, что влечет за собой загрязнение рабочих зон, земли, воды и, как следствие, пищевых продуктов, использование которых неизбежно приводит к иммунодепрессии. Особенное место в данной проблеме занимает стресс, который сопутствует практически любой профессиональной деятельности. Сезонная адаптация также сопровождается иммунодефицитами, которые являются одной из главных причин подъема "простудных. заболеваний. Последние закономерно "тянут" за собой "хвост" разнообразной соматической патологии. По данным ВОЗ большинство известных заболеваний приводят к иммунодефициту или к его усугублению. Паши многолетние исследования, проведенные на предприятиях, расположенных в разных географических зонах России, неизменно позволяли регистрировать два пика подъема общей и инфекционной заболеваемости: весной и осенью. Эти данные были использованы при обосновании сроков проведения массовой индивидуальной профилактики. Таким образом, использованный метод иммунодиагностики выявил удельный вес вторичных иммунодефицитов в разных профессиональных коллективах и послужил рациональному формированию групп профи-лактируемых при массовой иммунопрофилактике. При индивидуальном подходе иммунодиагностика, кроме того, способствует правильному выбору иммунофармакологических средств для иммунокоррекции и реабилитации. Анализ литературы, посвященной иммуномодулирукхцим препаратам, в последнее время демонстрирует всплеск исследований, предпринимаемых в этом направлении, что настоятельно требует проведения контролируемых опытов по количественной оценке эффективности многочисленных иммунофармакологических средств, скрининга и классификации потока препаратов, находящихся на рапных стадиях разработок. Нами предложен вариант классификации, где принципиально не рассматривались так называемые пищевые добавки, быстро заполнившие отечественный фармацевтический рынок. Проблема количественной оценки иммуномодуляторов нашла свое решение путем адаптации методологии проведения полевых эпидемиологических опытов по оценке вакцин. Работы по диагностике и профилактике вторичных иммунодефицитов были начаты в 1979 г. в сборных командах страны по разным видам спорта. Социальный заказ носил простую формулировку: разобраться в феномене заболеваемости на пике спортивной формы спортсменов, которые не выходили на старты ответственных соревнований из-за болезни. Анализ заболеваемости свидетельствовал о преобладании так называемых "простудных" форм/ (ОРЗ, грипп, ангина, пневмония), т.е. тех инфекций, против которых не было предложено вакцин или имеющиеся обладали низкой эффективностью. Было высказано предположение о том, что альтернативой вакцииопрофилактике могла стать антиген -неспецифическая иммунопрофилактика, призванная препятствовать развитию вторичных иммунодефицитов, являющихся причиной развития болезни. В начале 90-х годов в экспериментах, проведенных у нас в стране и за рубежом, были получены сенсационные данные: введение в рацион иммунодефицитных мышей только одной аминокис- лоты существенно повышало функции системы иммунитета животных. Эти фак-ты свидетельствовали о том, что иммунная недостаточность может иметь метаболический характер. В работах, посвященных изучению действия иммуномодуляторов, появились исследования, демонстрирующие большую эффективность схем профилактики, включающих несколько видов препаратов, в сравнении с использованием одного. В 1987 г. С.Н.Кузьминым выдвинута концепция зкстраиммунного (трансиммунного) типа модуляции, включающая в схему профилактики адаптогены, витамины, микроэлементы и иммуноактивные метаболиты. Данный подход отличается от интраиммунного типа модуляции тем, что используются препараты прямого действия (тактивин, миелопнд, интерлейкины, нейропентиды и др.). Как свидетельствует анализ литературы, за всю историю использования иммуноактивных фармакологических средств в практике клинической иммунологии не было опубликовано отрицательных результатов. В команде гребцов индивидуальная иммунопрофилактика па протяжении двух лет (срок наблюдений) исключила всякую заболеваемость, документировано повысила производительность (объем тренировочных нагрузок) и эффективность труда спортсменов: завоевано пять сверхплановых золотых медалей первенства мира. Все это нашло свое подтверждение в использованных иммунологических тестах. В дальнейшем была разработана технология массовой иммунопрофилактики для промышленных предприятий и других организованных коллективов. В специальных исследованиях проведен сравнительный анализ известных методов отбора групп иммунологического риска. Сравнительному анализу были подвергнуты метод отбора по результатам иммунологического обследования, метод анкетирования и метод, использующий данные медицинской статистики. Результаты выявили явные преимущества последнего по временному и экономическому критериям. Например, иммунологическнй принцип, используемый при индивидуальной работе, непомерно увеличивал расходы и без того достаточно дорогого мероприятия. Анкетирование требовало больших временных и трудовых затрат по сбору и обработке информации в сжатые сроки. Отбор иммунокомпрометированных лиц по результатам анализа ретроспективной заболеваемости в коллективе с иммунологи-ческим подтверждением в репрезентативной выборке (10% от численности группы риска) оказался для массовых исследований наиболее оптимальным. Авторы, отдавая себе отчет в несовершенстве существующего учета заболеваемости, сочли возможным дополнить группы иммунологического риска представителями переносящими простудные заболевания "на ногах", без оформления больничных листков. Как показали дальнейшие исследования, использованный подход вполне оправдал себя, поскольку таким образом сформированные группы риска мужского пола старше 50 и женского старше 45 лет, что соответствует данным литературы о возрастных иммуподефицитах. Кроме того, группы профилактируемых были дополнены лицами, давали предприятиям более 80% общей заболеваемости. В строго контролируемых опытах была получена ипформация о прямо пропорциональной зависимости эффекта профилактики от степени охвата группы профилактнруемых. Положительный результат профилактики может быть получен только при более чем 60% охвате и, что не менее важно, соблюдении принципа кратности введения препаратов каждым профилактируемым: не менее 11 раз из необходимых 15 кратных введений. Длительность эффекта профилактики прослеживалась на протяжении но менее 3-х месяцев после последнего приема препаратов. При анализе материалов 8-летней иммунопрофилактики (срок наблюдений) на промышленном предприятии не было отмечено эффекта привыкания к действию использованных иммупомодуляторов. Более того, эффективность имела выраженную тенденцию роста в зависимости от проведения повторных курсов. В другом контролируемом опыте была исследована количественная эффективность двух схем экстраиммунной профилактики: первая схема включала нуклеинат натрия, ундевит и экстракт элеутерококка, вторая схема рибоксин, ундевид и экстракт элеутepoкокка. В этом исследовании были использованы дозы введения препаратов, соответствующие отечественной фармакопее. Схема профилактики предусматривала пятнадцатикратное введение комплекса на протяжении 20-45 дней. В результате общая заболеваемость на предприятии снизилась в первой группе на 52,7%, во второй - на 39,3%, в то время как в группе плацебо отмечено повышение ее па 6,8%). Таким образом, впервые в рамках строго контролируемых опытов была показана выраженная количественная эффективность иммунопрофилактики и обоснована целесообразность включения в профилактические схемы нуклеината натрия, что соответствует данным литературы, Следует подчеркнуть, что в доступной литературе работ, посвященных контролируемым испытаниям по количественной оценке эффективности иммуномодуляторов, опубликовано не было. Углубленный анализ полученных данных позволяет сделать заключение о влиянии профилактических мероприятий на структуру заболеваемости: профилактика приводила к снижению не только инфекционной, но и сердечно-сосудистой заболеваемости на 38%, заболевании органов дыхания - на 66%, желудочно-кишечного тракта - на 44% и болезней кожи - на 53% (табл. 2) в сравнении с данными пятилетней ретроспективной заболеваемости. Иммунопрофилактика, проведенная среди 200 тыс. человек на 20 промышленных предприятиях России (Липецкий металлургический комбинат, "Трехгорка", завод "Динамо", Тулачермет, Невинномысскии "Азот" и др.) неизменно приводила к снижению общей заболеваемости до 53%, что находило соответствие с нормализацией фукции иммунной системы. По материалам исследований изданы методические рекомендации "Метод снижения заболеваемости у рабочих и служащих предприятий и организаций" (М., 1990) Обсуждая представленные результаты, необходимо подчеркнуть, что основной массив данных был получен при проведении массовой иммунопрофилактики. Итоги работы свидетельствуют о выраженной эффективности экстраиммунного типа модуляции иммунологической реактивности человека. Впервые Проведены строго контролируемые исследования по количественной оценке эффективности двух иммунопрофилактических комплексов, что облегчит проведение дальнейших разрабо ток в этом направлении. В настоящее время не вызывает сомнений, что иммунопро-филактические препараты должны иметь количественную характеристику эффективности. Все это относится и к многочисленным пищевым добавкам, получившим уже достаточно широкое распространение. Итоги работы позволяют сделать три главных вывода: 1. Антигеннеспецифическоя иммунопрофилактика экстраиммунного типа в испытанных дозах и схемах безвредна для человека и практически полностью исключает риск раз вития каких бы то ни было осложнений. 2. Проведенные исследования не выявили эффекта привыкания к использованным дозам препаратов, более того, эффективность профилактики имеет выраженную тенденцию роста от проведения повторных курсов. 3. Использованные методы иммунодиагностики продемонстрировали частоту развития вторичных иммунодефицитных состояний в разных группах обследованных, что с достаточным основанной можно рассматривать как донозологическую диагностику патологических процессов. Все это позволяет выстроить цепочку событий в патогенезе. Не вызывает сомнений точка зрения о том, что нормальная функция иммунной системы ставит достаточно эффективный "запрет" развитию многих болезней. Иммунная недостаточность "открывает двери" заболеваемости. Другими словами, иммунодефицит является детонатором развития патологии. Выявленная частота вторичных иммунодефицитов характеризует экологическую ситуацию зоны обитания обследуемых. Стресс, сопровождающий трудовую деятельность человека, вносит свой существенный вклад в иммунодепрессию. Наш метод, прошедший этапы разработки и внедрения в практику, следует рассматривать как важное государственное мероприятие для снижения заболеваемости. Дальнейшее внедрение должно сопровождаться работами, связанными с анализом механизмов действия иммуномодуляторов разной природы. Сегодня не вызывает сомнений, что использование для профилактики одного иммуномодулятора уступает по эффективности комплексу из нескольких видов. В этой связи вызывают удивление широкомасштабные профилактические мероприятия против гриппа, проводимые органами здравоохранения у нас в стране, с использованием только одного иммуномодулятора - дибазола. В наших исследованиях прослежена жесткая зависимость эффекта профилактики от кратности введения препаратов. Показано, что действие модуляторов наступает только после 11-кратного введения. В настоящее время проанализированы данные по 15-20-кратной профилактике. Развитие работ в данном направлении представляет собой значительный интерес. Организаторы работ по иммунопрофилактике несомненно будут заинтересованы в сокращении кратности приемов. Однако повышение эффекта профилактики, связанное с увеличением количеств приема, должно быть принято во внимание. Среди множества проблем, стоящих перед иммунопрофилактикой, следует выделить направление, которое должно дать рекомендации по использованию антигеннеспецифической иммунопрофилактики при угрозе эпидемий, к возбудителям, против которых отсутствуют вакцинные препараты или имеются вакцины низкой эффективности. Другой аспект данной проблемы заключается в том, что вакцинация иммунокомпрометированных лиц с учетом современных знаний в области клинической иммунологии абсурдна. Иммунореабилитационные мероприятия, предшествующие вакцинации, могут решить данную проблему.  |